Vil natrium give op elektroner til andre atomer?
* Elektronkonfiguration: Natrium har en elektron i sin yderste skal (valensskal). Denne enkelt elektron er løst bundet og relativt let at fjerne.
* Elektropositivitet: Natrium er meget elektropositiv, hvilket betyder, at det har en stærk tendens til at miste elektroner og blive positivt ladet.
* octet regel: Ved at miste en elektron opnår natrium en stabil oktetkonfiguration i sin yderste skal, som er en mere energisk gunstig tilstand.
hvordan natrium danner ioner:
Når natrium reagerer med andre atomer, mister det sin yderste elektron for at danne en positivt ladet ion, Na⁺. Denne proces kaldes ionisering .
Eksempler:
* reaktion med klor: Natrium reagerer med klor til dannelse af natriumchlorid (NaCI). Natrium mister sin elektron til klor og danner Na⁺ og Cl⁻ioner, som derefter tiltrækker hinanden på grund af deres modsatte ladninger.
* reaktion med vand: Natrium reagerer kraftigt med vand, frigiver brintgas og danner natriumhydroxid (NaOH). Natriumatomet mister sit elektron til dannelse af na⁺ioner.
Sammenfattende gør Sodiums tendens til at miste sin yderste elektron det til et meget reaktivt element, der let danner ioniske bindinger med andre elementer.
 Varme artikler
Varme artikler
-
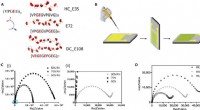 Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og
Design af en fritstående, superladet polypeptid-proton-ledende membranDC_E108. Kredit:Science Advances, doi:10.1126/sciadv.abc0810 Protoner er subatomære partikler med en positiv elektrisk ladning. Proton -translokation spiller en væsentlig rolle i naturfænomener og -
 Undersøgelse viser, at justering af et lag atomer på en katalysatoroverflade kan få det til at fu…En illustration kombinerer to mulige typer overfladelag til en katalysator, der udfører vandspaltningsreaktionen, det første skridt i fremstillingen af brintbrændstof. Den grå overflade, top, er lan
Undersøgelse viser, at justering af et lag atomer på en katalysatoroverflade kan få det til at fu…En illustration kombinerer to mulige typer overfladelag til en katalysator, der udfører vandspaltningsreaktionen, det første skridt i fremstillingen af brintbrændstof. Den grå overflade, top, er lan -
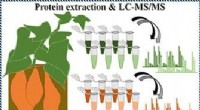 Udgravning af sød kartoffel proteomKredit:American Chemical Society Den søde, stivelsesholdige orange søde kartofler er velsmagende og nærende ingredienser til fritter, gryderetter og tærter. Selvom mennesker har dyrket søde kartof
Udgravning af sød kartoffel proteomKredit:American Chemical Society Den søde, stivelsesholdige orange søde kartofler er velsmagende og nærende ingredienser til fritter, gryderetter og tærter. Selvom mennesker har dyrket søde kartof -
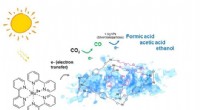 Ny lysaktiveret katalysator fanger CO2 for at lave ingredienser til brændstofSkematisk af en svampet nikkel-organisk fotokatalysator, der udelukkende omdanner carbondioxid til carbonmonoxid, som yderligere kan omdannes til flydende brændstof af høj værdi gennem synlig lys-indu
Ny lysaktiveret katalysator fanger CO2 for at lave ingredienser til brændstofSkematisk af en svampet nikkel-organisk fotokatalysator, der udelukkende omdanner carbondioxid til carbonmonoxid, som yderligere kan omdannes til flydende brændstof af høj værdi gennem synlig lys-indu
- Når en organisme kan overleve uden ilt kaldes det dette?
- Opvarmning af proteiner for at forstå, hvordan gener fungerer
- Hvad er de forskellige typer geoder?
- Hvor mange homologe kromosomer har du i dine gameter?
- Hvorfor ville du veje mindre på månen, men din masse forbliver den samme?
- Fremtiden for 1 milliard mennesker i Sydasien afhænger af vandpagten, siger ny analyse


