Er alle metalhydroxider stærke opløselige baser?
* Stærke baser: Stærke baser ioniseres fuldstændigt i opløsning, hvilket betyder, at de frigiver alle deres hydroxidioner (OH-) i opløsningen. De er typisk alkalimetalhydroxider (som NaOH, KOH) og nogle alkaliske jordmetalhydroxider (som Ca (OH) 2, SR (OH) 2).
* svage baser: Svage baser ioniserer kun delvist i opløsningen, hvilket betyder, at de frigiver nogle, men ikke alle, af deres hydroxidioner. Mange metalhydroxider falder ind i denne kategori.
Faktorer, der påvirker opløselighed og styrke af metalhydroxider:
* kationstørrelse og ladning: Mindre, højt ladede kationer har en tendens til at danne mere stabile, mindre opløselige hydroxider. Dette skyldes, at den mindre kation har en større ladningstæthed, hvilket fører til stærkere attraktioner til hydroxidionerne.
* polariserbarhed: Flere polariserbare kationer (dem med større elektronskyer) danner flere opløselige hydroxider, fordi hydroxidionerne er mere tiltrukket af den større elektronsky.
* gitterenergi: Jo højere gitterenergi af metalhydroxidet er, desto mindre opløseligt vil det være.
Eksempler:
* stærke opløselige baser: Naoh, Koh, CA (OH) 2
* svage baser: Fe (OH) 3, AL (OH) 3, CU (OH) 2, MG (OH) 2
Key Takeaway: Opløselighed og styrke er relateret, men ikke det samme. Et metalhydroxid kan være opløseligt, men svagt eller uopløseligt, men stærkt. For eksempel er Fe (OH) 3 meget uopløselig, men en stærk base, når den opløses.
Sidste artikelHvad ville være den empiriske formel for hexan C5H14?
Næste artikelHvilken type molekyle er 2-methylpenten?
 Varme artikler
Varme artikler
-
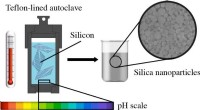 En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn
En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn -
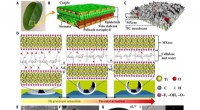 Bioinspireret MXene-baserede aktuatorer til programmerbare smartenhederDen udførlige struktur, komponenter, og aktiveringsmekanisme for den MXene-cellulosebaserede aktuator. (A) Fotografi af et naturligt blad. (B) Skematisk diagram af en bladstruktur. (C) Skematisk diagr
Bioinspireret MXene-baserede aktuatorer til programmerbare smartenhederDen udførlige struktur, komponenter, og aktiveringsmekanisme for den MXene-cellulosebaserede aktuator. (A) Fotografi af et naturligt blad. (B) Skematisk diagram af en bladstruktur. (C) Skematisk diagr -
 Ny prøveholder til proteinkrystallografiOp til tre individuelle dråber kan anbringes på prøveholderen. Kredit:HZB Proteiner er enorme molekyler, der ofte har kompleks tredimensionel struktur og morfologi, der kan omfatte sidekæder, fold
Ny prøveholder til proteinkrystallografiOp til tre individuelle dråber kan anbringes på prøveholderen. Kredit:HZB Proteiner er enorme molekyler, der ofte har kompleks tredimensionel struktur og morfologi, der kan omfatte sidekæder, fold -
 En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt
En kemisk omfavnelse fra den perfekte værtGengwu Zhang udfører adskillelseseksperimentet ved hjælp af to ekstraktionstårne. Kredit:© 2020 KAUST En industriel proces, der i øjeblikket bruger store mængder energi i petrokemiske anlæg rundt


