Hvor mange hydrogenatomer er der i 1 kg?
* brint er et element: Det findes som individuelle atomer (H), men danner også molekyler som diatomisk brint (H₂) og forbindelser som vand (H₂O).
* masse og antal atomer: Massen af et stof afhænger af antallet af atomer * og * den type atomer, der er til stede.
Her er, hvordan man nærmer sig dette problem:
1. Angiv stoffet: Spørger du om rent brint (H₂), vand (H₂O) eller noget andet?
2. Beregn mol: Brug stoffets molære masse til at konvertere 1 kg til mol.
* For eksempel er den molære masse af H₂ 2 g/mol. Så 1 kg (1000 g) H₂ er 1000 g / 2 g / mol =500 mol.
3. Brug Avogadro's nummer: En mol af ethvert stof indeholder 6,022 x 10²³ partikler (atomer, molekyler osv.).
* I vores H₂ -eksempel indeholder 500 mol H₂ 500 mol * 6,022 x 10²³ molekyler/mol =3,011 x 10²⁶ molekyler af H₂.
4. Konto for hydrogenatomer pr. Molekyle: Da hvert H₂ -molekyle har to hydrogenatomer, multiplicerer antallet af molekyler med 2:3,011 x 10²⁶ molekyler * 2 atomer/molekyle =6,022 x 10²⁶ brintatomer.
Kortfattet:
* for 1 kg rent brint (H₂): Der er ca. 6,022 x 10²⁶ hydrogenatomer.
* for andre stoffer: Antallet af hydrogenatomer vil være forskellige afhængigt af den kemiske formel og molmassen af stoffet.
 Varme artikler
Varme artikler
-
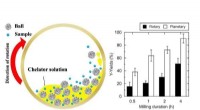 Forkortelse af sjældne jordarters forsyningskæde via genbrugFigur Skematisk afbildning af den chelator-assisteret våd-fræsning i en kuglemølle, og sammenligning af Y-udbyttet (procent) fra EoL-FL i roterende og planetariske kuglemøller. Kredit:Kanazawa Univers
Forkortelse af sjældne jordarters forsyningskæde via genbrugFigur Skematisk afbildning af den chelator-assisteret våd-fræsning i en kuglemølle, og sammenligning af Y-udbyttet (procent) fra EoL-FL i roterende og planetariske kuglemøller. Kredit:Kanazawa Univers -
 Ingen sukkerbelægning, men sød ikke desto mindreIngen sukkerbelægning. Kredit:Christian Böhler, Maria Asplund Komplekse neuroteknologiske anordninger er nødvendige for direkte at vælge og påvirke hjernebølger inde i kraniets indre. Selvom det e
Ingen sukkerbelægning, men sød ikke desto mindreIngen sukkerbelægning. Kredit:Christian Böhler, Maria Asplund Komplekse neuroteknologiske anordninger er nødvendige for direkte at vælge og påvirke hjernebølger inde i kraniets indre. Selvom det e -
 Bæredygtig vandkvalitetssensor lavet af menneskehår-afledte kulstofprikkerKredit:CC0 Public Domain Griffith University-forskere har brugt menneskehåraffald til at udvikle bæredygtige organiske højteknologiske enheder til vandkvalitetstest af forurenende stoffer. Profes
Bæredygtig vandkvalitetssensor lavet af menneskehår-afledte kulstofprikkerKredit:CC0 Public Domain Griffith University-forskere har brugt menneskehåraffald til at udvikle bæredygtige organiske højteknologiske enheder til vandkvalitetstest af forurenende stoffer. Profes -
 Bedre forståelse af principperne for siliciumætsning fører til forbedret overflademønsterVed hjælp af nøje udvalgte kombinationer af metaller, det er muligt at etse indviklede mønstre på en siliciumoverflade, som vist ovenfor. Kredit:Ref. 1 og licenseret under CC BY 4.0 © 2016 L. Kong et
Bedre forståelse af principperne for siliciumætsning fører til forbedret overflademønsterVed hjælp af nøje udvalgte kombinationer af metaller, det er muligt at etse indviklede mønstre på en siliciumoverflade, som vist ovenfor. Kredit:Ref. 1 og licenseret under CC BY 4.0 © 2016 L. Kong et
- Ny lysforstærker kan booste potentialet i fotonik
- Forklarer:Hvad er antistof?
- Life Science er studiet af levende ting, der lister 10 måder dit liv er blevet påvirket på, fordi…
- Hvad er tætheden af luft ved 0 C?
- Gallium i måneprøver forklarer tab af måner, der let fordamper elementer
- Naturressourcer værdsat forskelligt af mænd og kvinder, undersøgelse viser


