Hvordan kan brug af loven om bevaringsmasse til at hjælpe dig med at afbalancere en kemisk ligning?
Sådan kan du bruge denne lov til at afbalancere en kemisk ligning:
1. Identificer reaktanter og produkter: Skriv de kemiske formler for alle reaktanter og produkter, der er involveret i reaktionen.
2. tæl atomerne for hvert element: For hvert element tæller antallet af atomer, der er til stede på reaktantenes side og produkternes side af ligningen.
3. Juster koefficienter: Brug koefficienter (tal foran de kemiske formler) til at afbalancere antallet af atomer i hvert element på begge sider af ligningen. Husk, at koefficienter multiplicerer hele den kemiske formel.
4. Kontroller balancen: Efter justering af koefficienterne kontrollerer dobbeltkontrol, at antallet af atomer i hvert element er det samme på begge sider.
Eksempel:
Lad os afbalancere ligningen for forbrænding af metan:
ch₄ + o₂ → co₂ + h₂o
* reaktanter: CH₄ (Methan) og O₂ (Oxygen)
* Produkter: CO₂ (kuldioxid) og H₂O (vand)
Tælling af atomer:
* reaktanter:
* C:1
* H:4
* O:2
* Produkter:
* C:1
* H:2
* O:3
afbalancering:
* For at afbalancere brintatomerne skal du sætte en koefficient på 2 foran H₂O:
ch₄ + O₂ → CO₂ + 2H₂O
* Nu har vi 4 timers atomer på begge sider, men vi har 4 iltatomer på produktsiden og 2 på reaktantsiden. For at afbalancere dette skal du sætte en koefficient på 2 foran O₂:
ch₄ + 2o₂ → CO₂ + 2H₂O
Nu er ligningen afbalanceret:
* reaktanter:
* C:1
* H:4
* O:4
* Produkter:
* C:1
* H:4
* O:4
Loven om bevarelse af masse er vigtig for at afbalancere kemiske ligninger, fordi det sikrer, at det samme antal atomer i hvert element er til stede på begge sider af ligningen, hvilket repræsenterer virkeligheden uden atom, der oprettes eller ødelægges under en kemisk reaktion.
 Varme artikler
Varme artikler
-
 Et mere miljøvenligt klimaanlægEt prototype kølesystem bruger nye solid-state barokaloriske materialer. Kredit:Adam Slavney Sommeren er i fuld gang i USA, og folk skruer op for deres klimaanlæg for at slå varmen. Men hydrofluorc
Et mere miljøvenligt klimaanlægEt prototype kølesystem bruger nye solid-state barokaloriske materialer. Kredit:Adam Slavney Sommeren er i fuld gang i USA, og folk skruer op for deres klimaanlæg for at slå varmen. Men hydrofluorc -
 Økologisk strømlagringsbatteri lavet af vanillinTU Graz-forsker Stefan Spirk har fundet en måde at erstatte flydende elektrolytter i redoxflow-batterier med vanillin. Kredit:Lunghammer - TU Graz Forskere ved TU Graz har fundet en måde at omdann
Økologisk strømlagringsbatteri lavet af vanillinTU Graz-forsker Stefan Spirk har fundet en måde at erstatte flydende elektrolytter i redoxflow-batterier med vanillin. Kredit:Lunghammer - TU Graz Forskere ved TU Graz har fundet en måde at omdann -
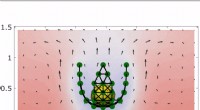 Forskere udvikler selvdrevet mikrofluidisk ark, der omslutter, klapper og krybEn animation af udpakningen af et katalse-belagt blomsterlignende ark omkring en kapsel. Sorte pile angiver retningen og størrelsen af flowfeltet i opløsningen. Kredit:Abhrajit Laskar Det tryl
Forskere udvikler selvdrevet mikrofluidisk ark, der omslutter, klapper og krybEn animation af udpakningen af et katalse-belagt blomsterlignende ark omkring en kapsel. Sorte pile angiver retningen og størrelsen af flowfeltet i opløsningen. Kredit:Abhrajit Laskar Det tryl -
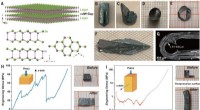 Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan
Forskere finder, at krystaller af indiumselenid har enestående fleksibilitetDeformerbarhed af InSe enkeltkrystaller. (A) Krystalstruktur af β-InSe og projektionen på (110) og (001) planerne. (B) Som-vokset krystal og (C) spaltningsoverflade. (D til F) InSe enkeltkrystal omdan
- Hvilket læseniveau er nymåne?
- Hvor mange grader F er en kelvin?
- Hvad er forholdet mellem nettokraft, der udøves på et objekt og dets acceleration?
- Hvilke bølger forekommer, når bevægelsen af medium ved er rigtige vinkler til retningsbølge?
- Hvilket kemikalie gør en løg skarp?
- Sådan optimerer du online læring i en tid med coronavirus


