Hvad er den molekylære formel for en forbindelse med .5331 carbon .1118 hydrogen og .3551 Oxygen molær masse 90.122 gram pr. Mol?
1. Konverter masseprocentdel til gram:
* Antag, at du har 100 g af forbindelsen. Dette betyder, at du har:
* 53,31 g kulstof
* 11,18 g brint
* 35,51 g ilt
2. Konverter gram til mol:
* Opdel massen af hvert element med dets molære masse:
* Kulstof:53,31 g / 12,01 g / mol =4,44 mol
* Hydrogen:11,18 g / 1,01 g / mol =11,07 mol
* Oxygen:35,51 g / 16,00 g / mol =2,22 mol
3. Find det enkleste molforhold:
* Opdel hver molværdi med den mindste molværdi (2,22 mol i dette tilfælde):
* Carbon:4,44 mol / 2,22 mol =2
* Hydrogen:11,07 mol / 2,22 mol =5
* Oxygen:2,22 mol / 2,22 mol =1
4. Bestem den empiriske formel:
* Det enkleste forhold mellem hele nummeret er c₂h₅o.
5. Beregn den empiriske formelmasse:
* C₂H₅O:(2 x 12,01) + (5 x 1,01) + (1 x 16,00) =45,07 g/mol
6. Find molekylformlen:
* Opdel den givne molmasse med den empiriske formelmasse:
* 90,122 g/mol/45,07 g/mol ≈ 2
* Multiplicer underskrifterne i den empiriske formel med denne faktor (2):
* C₂h₅o x 2 = c₄h₁₀o₂
Derfor er den molekylære formel for forbindelsen c₄h₁₀o₂.
 Varme artikler
Varme artikler
-
 Nyt værktøj gør det muligt for forskere at fange undvigende protein i aktionMed spastazolin, forskere kan studere tidligere utilgængelige komponenter i celledeling. Kredit:Rockefeller University Ligesom mange af de processer, der driver en celles grundlæggende funktioner,
Nyt værktøj gør det muligt for forskere at fange undvigende protein i aktionMed spastazolin, forskere kan studere tidligere utilgængelige komponenter i celledeling. Kredit:Rockefeller University Ligesom mange af de processer, der driver en celles grundlæggende funktioner, -
 Superhurtig indsigt i mobilbegivenhederFrankfurt-forskere fulgte bevægelserne af dette lille molekyle - kun to tusindedele af tykkelsen af et stykke papir. RNA-aptameren ændrer sin struktur, når den binder hypoxanthin. De grønne nukleoba
Superhurtig indsigt i mobilbegivenhederFrankfurt-forskere fulgte bevægelserne af dette lille molekyle - kun to tusindedele af tykkelsen af et stykke papir. RNA-aptameren ændrer sin struktur, når den binder hypoxanthin. De grønne nukleoba -
 Forståelse af relaxor ferroelektriske egenskaber kan føre til mange fremskridtChirale (spejl) molekyler giver relaxor ferroelektriske stoffer deres fantastiske egenskaber. Kredit:MR, Penn State En ny grundlæggende forståelse af polymer relaxor ferroelektrisk adfærd kan føre
Forståelse af relaxor ferroelektriske egenskaber kan føre til mange fremskridtChirale (spejl) molekyler giver relaxor ferroelektriske stoffer deres fantastiske egenskaber. Kredit:MR, Penn State En ny grundlæggende forståelse af polymer relaxor ferroelektrisk adfærd kan føre -
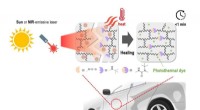 Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo
Beskyttende belægningsmateriale heler sig selv på 30 minutter, når det udsættes for sollysSelvhelbredende mekanisme af miljøvenligt beskyttende belægningsmateriale til køretøjer inklusive dynamisk polymernetværk og fototermisk farvestof. Kredit:Korea Research Institute of Chemical Technolo


