Hvorfor har aluminium oftest en oxidationstilstand på 3?
* Elektronisk konfiguration: Aluminium har et atomnummer på 13 med en elektronisk konfiguration af [NE] 3S² 3P¹. Dette betyder, at det har tre elektroner i sin yderste skal.
* tendens til at miste elektroner: Metaller har en tendens til at miste elektroner for at opnå en stabil, ædelgaskonfiguration. Aluminium kan opnå dette ved at miste sine tre valenselektroner og efterlade det med en fuld ydre skal (som neon, som er en ædel gas).
* Dannelse af al³⁺: Når aluminium mister tre elektroner, danner det en positivt ladet ion, al³⁺. Denne ion er meget stabil, fordi den har en komplet ydre skal af elektroner.
* ionisk binding: Al³⁺ionen danner let ioniske bindinger med ikke -metaller, som har en tendens til at få elektroner. Dette resulterer i dannelsen af forbindelser som aluminiumoxid (Al₂O₃) og aluminiumchlorid (ALCL₃).
Kortfattet: Aluminiums tendens til at miste tre elektroner for at opnå en stabil ædelgaskonfiguration og dens evne til at danne stabile ioniske bindinger med ikke -metaller fører til dens mest almindelige oxidationstilstand +3.
 Varme artikler
Varme artikler
-
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø -
 Isdannelse på overflader forstærket via en ikke-klassisk kernedannelsesprocesIskernedannelse på fremmede overflader kan forløbe via både et-trins (magenta pil) og to-trins (orange pile) veje, lettet af den afbalancerede synergetik, entropiske effekter af sekskantede (grønne ku
Isdannelse på overflader forstærket via en ikke-klassisk kernedannelsesprocesIskernedannelse på fremmede overflader kan forløbe via både et-trins (magenta pil) og to-trins (orange pile) veje, lettet af den afbalancerede synergetik, entropiske effekter af sekskantede (grønne ku -
 Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod
Tilslutning for at producere miljøvenlig bioplastKredit:Pixabay/CC0 Public Domain Bioplastik - bionedbrydelig plast fremstillet af biologiske stoffer i stedet for petroleum - kan fremstilles på en mere økonomisk og miljøvenlig måde ud fra biprod -
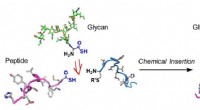 En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule
En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule


