En vindende kombination til glykoproteinsyntese

Glycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University
Mange processer i kroppen reguleres af proteinernes funktioner. For eksempel, næsten alle molekyler – såsom DNA, proteiner, oligosaccharider, og små bioaktive molekyler - genereres af enzymer. Imidlertid, ændringer i proteinfunktioner som reaktion på unormale forhold forårsager kritiske sygdomme. Forskere fra Osaka University har påvist en hurtig, robust kemisk metode til fremstilling af de meget rene (homogene) glycoproteiner, der er nødvendige for at undersøge disse ændringer. Deres resultater blev offentliggjort i Journal of the American Chemical Society .
Effektiviteten af enzymer og funktionelle proteiner reguleres af proteinmodifikationer. En typisk proteinmodifikation er glycosylering - tilføjelse af sukkerkæder kaldet glycaner til proteiner for at give glycoproteiner. Glykoproteiner findes på celleoverfladen og i kropsvæsker og spiller vigtige roller i mange biologiske processer. Imidlertid, de dannede glykoproteiner kan have mange forskellige glykanstrukturer. Derfor, at studere hvilke glykanstrukturer, der er afgørende for individuelle biologiske begivenheder, er udfordrende.
Produktionen af glykoproteiner såsom biologiske lægemidler - terapeutika fremstillet af, eller indeholdende komponenter af, levende organismer - bruger pattedyrcelleekspressionsmetoder, men det er ikke muligt at regulere strukturen af den glycan, der tilsættes proteinet. Kemisk syntese er derfor den bedste måde at lave homogene glykoproteiner, der er egnede til grundlæggende biologiske eksperimenter. Imidlertid, kemiske metoder kræver over 100 kemiske konverteringstrin og er tidskrævende.
Osaka-forskerne identificerede en hidtil uset og effektiv amidbindingsdannelsesreaktion mellem glycan-aminosyre og to peptider:diacyldisulfidkobling og thiosyreindfangningsligering. De viste, at glycosyl asparagin thiosyre udviste fremragende kemoselektiv kobling med peptider, og de anvendte betingelser kunne generere glycosylpolypeptid inden for nogle få kemiske omdannelsestrin.
"Vi brugte i det væsentlige glycosyl asparagin til at danne en forbindelse mellem to funktionelle peptider, giver et glykoprotein, " forklarer undersøgelsens første forfatter Kota Nomura. "Vi opnåede dette på blot et par trin, gør det til en yderst effektiv tilgang med lidt spild af værdifulde glycanmaterialer."
Holdet demonstrerede gennemførligheden af deres teknik ved at syntetisere to cytokinglycoproteiner. Cytokiner er vigtige bioaktive molekyler, der er involveret i inflammation og immunrespons. En pålidelig fremstilling af dem gav derfor et vigtigt bevis på nytten af den nye syntetiske rute.
"Vi har demonstreret et pålideligt middel til at syntetisere glycoproteiner, som vil muliggøre en grundig undersøgelse af glykans biologiske funktion, såvel som generering af biologiske lægemidler, ", forklarer den tilsvarende forfatter Yasuhiro Kajihara.
 Varme artikler
Varme artikler
-
 Nye metankoncentrationsteknologier til overvågning af drivhusgasemissionerLosseplads afbrændt flare. Kredit:Eddie Hagler/Public Domain Metankoncentrationerne i atmosfæren er mere end fordoblet i løbet af de sidste 150 år, og reduktion af methanemissioner vil spille en a
Nye metankoncentrationsteknologier til overvågning af drivhusgasemissionerLosseplads afbrændt flare. Kredit:Eddie Hagler/Public Domain Metankoncentrationerne i atmosfæren er mere end fordoblet i løbet af de sidste 150 år, og reduktion af methanemissioner vil spille en a -
 Omdanner kuldioxid til metan eller etan selektivt(a) Prøvebilleder opnået på forskellige stadier af syntese (b) Kumulativ metan- og etanudvikling for forskellige Pt vægtprocent sensibiliserede 0,50-G/RBT-prøver. Kredit:Daegu Gyeongbuk Institute of S
Omdanner kuldioxid til metan eller etan selektivt(a) Prøvebilleder opnået på forskellige stadier af syntese (b) Kumulativ metan- og etanudvikling for forskellige Pt vægtprocent sensibiliserede 0,50-G/RBT-prøver. Kredit:Daegu Gyeongbuk Institute of S -
 Nyt lavprismateriale til belysning og diagnostik producerer hvidt lys, der imiterer sollysHackmanitten udviklet af forskerne. Kredit:Universitetet i Turku Forskere ved Universitetet i Turku, Finland, har udviklet et syntetisk materiale baseret på det naturlige hackmanitmineral, som pro
Nyt lavprismateriale til belysning og diagnostik producerer hvidt lys, der imiterer sollysHackmanitten udviklet af forskerne. Kredit:Universitetet i Turku Forskere ved Universitetet i Turku, Finland, har udviklet et syntetisk materiale baseret på det naturlige hackmanitmineral, som pro -
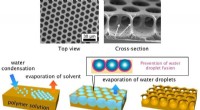 Ud af tågen:Honeycomb-filmSkematiske (nederst) og elektronmikrofotografier (øverst) af væksten af en honeycomb polystyrenfilm ved ånde-figur teknikken. Kredit:STAM Forskere producerer honeycomb-formede film ved hjælp af
Ud af tågen:Honeycomb-filmSkematiske (nederst) og elektronmikrofotografier (øverst) af væksten af en honeycomb polystyrenfilm ved ånde-figur teknikken. Kredit:STAM Forskere producerer honeycomb-formede film ved hjælp af
- Germanys strømpriser bliver negative,
- Ny metode til måling af nanostrukturerede lysfelter
- Uganda Airlines får første fly i genoplivningsbud
- Præcisionsmåling af protonernes svage ladning indsnævrer søgen efter ny fysik
- En ny grafen-matrix-assisteret stabiliseringsmetode vil hjælpe 2-D materialer med at blive en del a…
- Astrokemi:hvordan livet kan være begyndt i rummet


