Hvorfor øges atomstørrelse med reaktivitet for metaller og mindsker ikke -metaller?
metaller
* større atomstørrelse =mere reaktivitet: Metaller har en tendens til at miste elektroner for at danne positive ioner (kationer).
* I større atomer er den yderste elektron længere væk fra kernen og holdes mindre tæt af den positive ladning af kernen.
* Dette gør det lettere for atomet at miste sit yderste elektron og blive en kation, hvilket øger dens reaktivitet.
Eksempel:
* Kalium (K) er større end lithium (Li). Kalium er mere reaktiv, fordi dets ydre elektron er lettere at fjerne.
ikke -metaller
* mindre atomstørrelse =mere reaktivitet: Ikke -metaller har en tendens til at få elektroner til at danne negative ioner (anioner).
* I mindre atomer er den yderste elektronskal tættere på kernen og oplever en stærkere attraktion.
* Dette gør det lettere for atomet at tiltrække en yderligere elektron, hvilket øger dets reaktivitet.
Eksempel:
* Fluor (F) er mindre end jod (I). Fluor er mere reaktiv, fordi det lettere kan tiltrække en ekstra elektron for at afslutte sin ydre skal.
Kortfattet
* Metaller: Større atomstørrelse betyder svagere tiltrækning til ydre elektroner, hvilket fører til lettere tab af elektroner og øget reaktivitet.
* ikke -metaller: Mindre atomstørrelse betyder stærkere tiltrækning til ydre elektroner, hvilket fører til lettere forstærkning af elektroner og øget reaktivitet.
Vigtig note: Mens atomstørrelse er en nøglefaktor, spiller andre faktorer som ioniseringsenergi, elektronaffinitet og elektronegativitet også betydelige roller i bestemmelsen af et elements reaktivitet.
Sidste artikelEr iltatomet lidt negativt?
Næste artikelHvorfor er brintgas lettere end luft?
 Varme artikler
Varme artikler
-
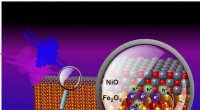 Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid
Styring af ladningsflow ved at styre elektronhullerForskere bruger ekstreme ultraviolette pulser (fuchsia linje) til at bestemme, hvordan synligt lys (blå linje) forårsager grænsefladehul (h + ) overførsel fra jernoxid (Fe 2 O 3 ) til nikkeloxid -
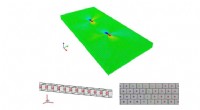 En ny måde at se stress på - ved hjælp af supercomputereSupercomputersimuleringer viser, at på atomniveau, materiel stress opfører sig ikke symmetrisk. Molekylær model af en krystal, der indeholder en dissocieret dislokation, atomer er kodet med atomforsky
En ny måde at se stress på - ved hjælp af supercomputereSupercomputersimuleringer viser, at på atomniveau, materiel stress opfører sig ikke symmetrisk. Molekylær model af en krystal, der indeholder en dissocieret dislokation, atomer er kodet med atomforsky -
 Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn
Planteforsvarslaget har uventet effekt på flygtige forbindelser, undersøgelse finderNatalia Dudareva og kolleger fandt ud af, at neglebåndet af petunia-blomster fungerer som en vask for flygtige forbindelser. I stedet for at udsende flere af disse forbindelser, når neglebåndet er tyn -
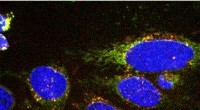 At spionere på cellers spisevaner kan hjælpe med at diagnosticere kræftForskere har udviklet en ny billedteknologi til at visualisere, hvad celler spiser, som kunne hjælpe med diagnosticering og behandling af sygdomme som kræft. Holdet har designet kemiske sonder, der ly
At spionere på cellers spisevaner kan hjælpe med at diagnosticere kræftForskere har udviklet en ny billedteknologi til at visualisere, hvad celler spiser, som kunne hjælpe med diagnosticering og behandling af sygdomme som kræft. Holdet har designet kemiske sonder, der ly
- Hjælper med at regulere den ioniske sammensætning af CNS -ekstracellulær væske?
- Et træ, der ejer sig selv, vokser i Athen,
- Hvorfor afgiver infrarøde bølger mest energi?
- Hvad er et lag af jorden, der indeholder delvist smeltet sten og meget høje temperaturer?
- Hvad er to typer bevis, som geologer bruger til at lære om jordens interiør?
- Hvorfor er kerneenergi kontroversiel?


