Hvad er Lewis -diagrammet for klorfluorid?
1. Tæl valenselektronerne:
* Chlor (CL) har 7 valenselektroner.
* Fluor (F) har 7 valenselektroner.
* Samlede valenselektroner:7 + 7 =14
2. Bestem det centrale atom:
* Klor er mindre elektronegativ end fluor, hvilket gør det til det centrale atom.
3. Tilslut atomerne med enkeltbindinger:
* Placer en enkelt binding (to elektroner) mellem klor- og fluoratomer:CL-F
4. Distribuer resterende elektroner:
* Chlor har nu 6 elektroner omkring det (2 i bindingen og 4 ikke-bonding).
* Fluor har også 6 elektroner omkring det (2 i bindingen og 4 ikke-bonding).
5. Kontroller Octet -regel:
* Både klor og fluor har nu 8 elektroner omkring dem, der tilfredsstiller oktetreglen.
Lewis -strukturen:
`` `
...
:CL:
|
F:
...
`` `
Nøglepunkter:
* Chloratomet har tre ensomme par elektroner.
* Fluoratomet har tre ensomme par elektroner.
* Den enkelte binding mellem klor- og fluoratomer er en polær kovalent binding, hvor fluoratomet er lidt mere elektronegativt.
Sidste artikelEr P4 et elementforbindelse eller molekyle?
Næste artikelEr nitrogenhydrogen en ionisk eller kovalent binding?
 Varme artikler
Varme artikler
-
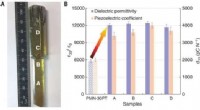 Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. (
Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. ( -
 Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste
Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste -
 Banebrydende ny genanvendelig klæbemiddel virker under vandetIllinois-forskere undersøgelse af formhukommelsespolymerer (SMPer) er omtalt i den seneste udgave af Advance Materials Interface . Kredit: Advance Materials Interface Illinois-forskere har intr
Banebrydende ny genanvendelig klæbemiddel virker under vandetIllinois-forskere undersøgelse af formhukommelsespolymerer (SMPer) er omtalt i den seneste udgave af Advance Materials Interface . Kredit: Advance Materials Interface Illinois-forskere har intr -
 Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen
Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen


