Hvordan ved du, at kalium et alkalimetal meget reaktivt?
1. Position på den periodiske tabel:
* alkali metal: Kalium (K) er bosiddende i gruppe 1 i den periodiske tabel, Alkali Metal -familien. Denne placering alene fortæller os, at den besidder de karakteristiske egenskaber ved alkalimetaller.
2. Elektronisk konfiguration:
* en valenselektron: Kalium har et elektron i sit yderste energiniveau (Valence Shell). Denne enkelt elektron holdes løst og taber let, hvilket gør det meget reaktivt.
3. Kemiske reaktioner:
* kraftige reaktioner med vand: Kalium reagerer voldsomt med vand og producerer brintgas og kaliumhydroxid. Denne reaktion er meget eksoterm og genererer nok varme til at antænde brintgas.
* reaktioner med ilt: Kalium reagerer let med ilt i luften og danner kaliumoxid. Dette oxid reagerer yderligere med fugt for at skabe kaliumhydroxid.
* reaktioner med halogener: Kalium reagerer kraftigt med halogener (som klor) for at danne ioniske salte (kaliumchlorid).
4. Fysiske egenskaber:
* blød, sølvfarvet metal: Kalium er et blødt, sølvhvid metal, som er en anden egenskab ved alkalimetaller.
* Lav smeltnings- og kogepunkter: Sammenlignet med andre metaller har kalium et relativt lavt smelte- og kogepunkt. Dette afspejler dens svage metalliske binding på grund af den loosely holdte valenselektron.
Konklusion:
Kombinationen af dens position på den periodiske tabel, elektronisk konfiguration og kemisk reaktivitet med forskellige stoffer viser, at kalium er et alkalimetal og faktisk er meget reaktiv.
 Varme artikler
Varme artikler
-
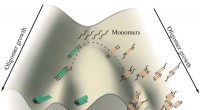 Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt
Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt -
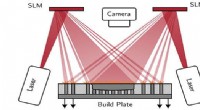 Holografisk stråleformning for at give et boost til metallisk 3-D-printAfdelingens set-up for additiv fremstilling (AM). Kredit:Peter Christopher Cambridge ingeniører har påbegyndt et treårigt forskningsprogram for at hjælpe med at fremskynde fremstillingen af meta
Holografisk stråleformning for at give et boost til metallisk 3-D-printAfdelingens set-up for additiv fremstilling (AM). Kredit:Peter Christopher Cambridge ingeniører har påbegyndt et treårigt forskningsprogram for at hjælpe med at fremskynde fremstillingen af meta -
 Forskere finder den optimale alder for stamcellerMulighedens vindue. Kredit:Daria Sokol/MIPT Biofysikere fra Moscow Institute of Physics and Technology og Vladimirsky Moscow Regional Clinical Research Institute har bestemt den optimale alder for
Forskere finder den optimale alder for stamcellerMulighedens vindue. Kredit:Daria Sokol/MIPT Biofysikere fra Moscow Institute of Physics and Technology og Vladimirsky Moscow Regional Clinical Research Institute har bestemt den optimale alder for -
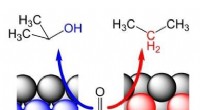 Konvertering af vedvarende råvarer til platin viser uventet adfærdAcetone (molekyle i midten) reagerer på propanol (venstre) eller propan (højre). De blå atomer i Pt(553) har et højt koordinationstal, de røde atomer i Pt(510) et lavt koordinationstal. Kredit:Leiden
Konvertering af vedvarende råvarer til platin viser uventet adfærdAcetone (molekyle i midten) reagerer på propanol (venstre) eller propan (højre). De blå atomer i Pt(553) har et højt koordinationstal, de røde atomer i Pt(510) et lavt koordinationstal. Kredit:Leiden
- Undersøgelse viser planetens atmosfæriske ilt steg gennem gletsjere
- EXPLAINER:Hvor vil Hawaiis største vulkan gå i udbrud fra?
- Afsaltning producerer mere giftigt affald end rent vand
- Sexarbejde i Sydafrika:Hvorfor både køb og salg skal være lovligt
- Hvilket mærke af gas indeholder ikke ethonol?
- Memory Hack:Lav noget aerobic fire timer efter timen


