Tumbleweeds eller fibriller:Tau-proteiner skal vælge
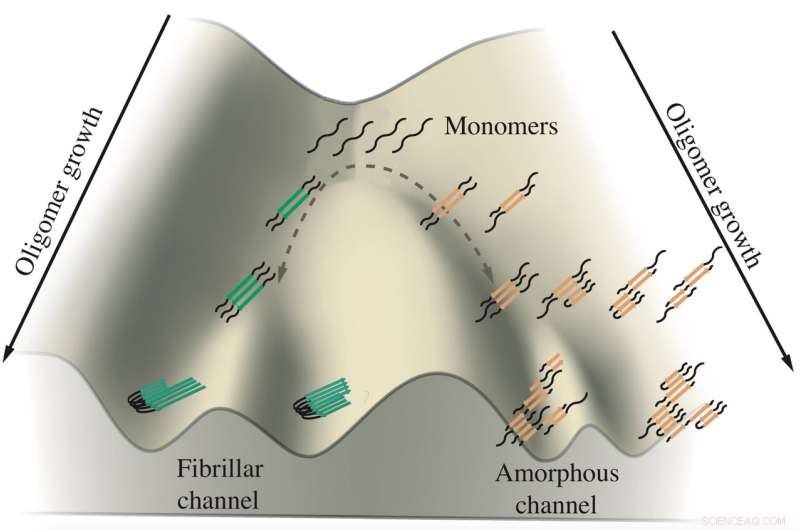
Et skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfiltringer, og den anden fører til amorfe klumper i neuroner. Rice University-forskere simulerede proteinerne i beregningsmodeller for at se, hvordan og hvor forgreningen sker. Kredit:Center for Teoretisk Biologisk Fysik
Nye simuleringer fra Rice University-forskere fortæller en historie om to taus, og hvordan de relaterer til neurologiske sygdomme.
Deres arbejde tyder på, at tau-proteiner tager en af to veje for at danne aggregater, der mistænkes for at fremme, og måske forårsager, Alzheimers og Picks (aka frontotemporal demens) sygdomme. Præcis hvorfor forbliver et mysterium, men at finde ud af det giver muligheden for at kontrollere deres skæbner.
Tau proteiner, især i neuroner, primært regulere mikrotubuli, filamenterne, der tjener som vejbaner for last inde i en celle og letter deling. Men de kommer i mange former og det viser sig, disse kan samles på forskellige måder.
Undersøgelsen af biofysiker Peter Wolynes og hans team i Proceedings of the National Academy of Sciences er den første beregningsanalyse, der skelner mellem proteiner, der enten danner de faste fibriller, der findes i hjernen hos patienter med Alzheimers og Picks eller forstyrrede, tumbleweed-lignende klumper, der flyder i neuronernes cytoplasma.
"Der er et forhold mellem den form, der bliver til membranløse organeller (tumbleweeds) og den form, der bliver til fibre, " sagde Wolynes, en meddirektør for Rice's Center for Teoretisk Biologisk Fysik. "Der ser ud til at være to adskilte veje, som det samme tau-molekyle kan følge, og balancen mellem de to veje påvirkes af en eller anden biologisk proces."
Han sagde, at modellerne tyder på, at fosforylering, som regulerer mange cellulære signalprocesser, kan være den afgørende faktor.
"Når vi finder ud af, hvilken af disse aggregater der er den faktiske onde fyr, så burde det være muligt at gribe ind, sige, selve fosforyleringsprocessen for at ændre balancen, " sagde Wolynes.
Rislaboratoriet brugte sin grovkornede AWSEM (associativ hukommelse, vand-medieret, struktur og energimodel) analyseværktøj, som forudsiger, hvordan proteiner folder, på en række tau-proteinmodeller baseret på varianter fra patienter. De fandt ud af, at dannelsen af fibre kan manipuleres ved phosphorylering, som forekommer på et væld af steder i tau-proteinet.
"Vi fandt, at phosphorylering fremmede dannelsen af det amorfe aggregat, men det fremmede ikke dannelsen af fiberen – i så høj grad, alligevel, " sagde Wolynes.
Fosforylering kan også gå af sporet, han sagde. "Der er noget i retning af 20 steder langs tau-proteinet, der kan phosphoryleres, men generelt, kun fire eller fem af dem er, " sagde Wolynes. "Men nogle gange, de er blevet hyperfosforylerede, hvilket betyder, at de enzymer, der er ansvarlige for processen, gør mere. De ender med, sige, 10 steder phosphoryleret i stedet for fem, og det kan have en vis effekt.
"Hvis den ekstra fosforylering kan forårsage mere af sygdommen, vi vil gerne finde ud af hvilke kinaser der fosforylerer og forsøge at hæmme dem med et lægemiddel, ligesom vi gør i behandling af kræft, " han sagde.
Tau-proteiner udviste en anden interessant egenskab kaldet backtracking, som forskerne så i amyloid beta-peptider, der også er impliceret i Alzheimers. Begge har en tendens til at samle sig, indtil energiske barrierer tvinger dem til delvist at udfolde sig og derefter søge en anden vej til deres endelige, mest stabile former.
Det er på det tidspunkt af frustration, at aggregerende taus ser ud til at forgrene sig i forskellige retninger, sagde Wolynes. Et sæt tau danner parallelle fibriller, der aggregerer til de ordnede plaques, der observeres i patienters hjerner, mens den anden løst aggregerer i den flydende klump. Forskerne foreslog, at tilbagesporingsmekanismen kan være en universel funktion i proteinaggregering, et emne til fremtidig undersøgelse.
De løse tilslag giver forskerne deres egne udfordringer, sagde Wolynes.
"De er et fysikspørgsmål i følgende betydning:De er lokaliserede objekter, men hvorfor glomer de ikke alle sammen og danner en kæmpe organel, som hvad der sker med dråber olie i vand?" sagde han. "Er det bare fordi det tager for lang tid for dem at bevæge sig rundt? Er det, at de konstant bliver lavet og adskilt? Og hvad bestemmer deres størrelse?
"På dette tidspunkt, det er stadig en meget grundlæggende og ret simpel historie, " sagde Wolynes. "Den faktiske historie om tau er stadig for kompliceret for os, men det, vi har lært indtil videre, er ret ligetil."
Sidste artikelAt finde kilden til kemiske reaktioner
Næste artikelNyt elektrodedesign kan føre til kraftigere batterier
 Varme artikler
Varme artikler
-
 Sådan Identificeres Dele af et AtomVi ved nu ganske lidt om atomets indre, den grundlæggende byggesten af naturen. Der er blot nogle få grundlæggende dele af et atom, og mens det ville være svært for den gennemsnitlige person faktisk
Sådan Identificeres Dele af et AtomVi ved nu ganske lidt om atomets indre, den grundlæggende byggesten af naturen. Der er blot nogle få grundlæggende dele af et atom, og mens det ville være svært for den gennemsnitlige person faktisk -
 Hvad er en forbindelse?Ved du, at du bruger forbindelser hver dag uden engang at tænke over det? Alle forbindelser inkluderer en vare lavet af to eller flere genstande, der er bundet sammen for at oprette den nye vare. D
Hvad er en forbindelse?Ved du, at du bruger forbindelser hver dag uden engang at tænke over det? Alle forbindelser inkluderer en vare lavet af to eller flere genstande, der er bundet sammen for at oprette den nye vare. D -
 Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov
Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov -
 Kornmarker kunne spille en rolle i genbrug af gammel elektronikKredit:Ames Laboratory En ny biokemisk udvaskningsproces er blevet udviklet, der bruger majskomfur som råmateriale, og genvinder værdifulde sjældne jordarters metaller fra elektronisk affald. Det
Kornmarker kunne spille en rolle i genbrug af gammel elektronikKredit:Ames Laboratory En ny biokemisk udvaskningsproces er blevet udviklet, der bruger majskomfur som råmateriale, og genvinder værdifulde sjældne jordarters metaller fra elektronisk affald. Det
- Autonome køretøjer kan være en miljømæssig fordel eller katastrofe, afhængig af den offentlige…
- Suomi NPP oplever, at tropisk depression Haikui forsvinder
- Blodmåneformørkelse glæder unge kenyanere
- Kan en kunstig intelligens betragtes som en person under loven?
- Lad ikke Huawei hjælpe med at opsætte 5G, USA advarer EU-lande
- Nanomateriale af en ny klasse


