Hvad er den kemiske reaktion, når NAHCO3 bruges til at neutralisere syre fra et bilbatteri?
reaktion:
NAHCO3 (aq) + H2SO4 (aq) → Na2SO4 (aq) + H2O (l) + CO2 (g)
Forklaring:
* natriumbicarbonat (NAHCO3) er en svag base, ofte kendt som bagepulver.
* svovlsyre (H2SO4) er en stærk syre.
* natriumsulfat (NA2SO4) er et salt dannet i reaktionen.
* vand (H2O) produceres som et resultat af neutraliseringen.
* kuldioxid (CO2) frigives som en gas, der forårsager den fizzing, du måske observerer.
Reaktionen kan sammenfattes i to trin:
1. neutralisering: Hydrogenionerne (H+) fra svovlsyren reagerer med bicarbonationerne (HCO3-) fra natriumbicarbonatet for at danne vand og kulsyre (H2CO3):
H2SO4 (aq) + 2 NAHCO3 (aq) → Na2SO4 (aq) + 2 H2CO3 (aq)
2. nedbrydning: Kulsyren er ustabil og nedbrydes hurtigt til vand og kuldioxid:
2 H2CO3 (aq) → 2 H2O (L) + 2 CO2 (g)
Vigtig note: Mens natriumbicarbonat kan neutralisere syre, skal det bruges med forsigtighed. Det er ikke en erstatning for professionel vedligeholdelse af batteri. Hvis du spilder batterisyre, er det vigtigt at tage ordentlige sikkerhedsforholdsregler og søge professionel hjælp om nødvendigt.
 Varme artikler
Varme artikler
-
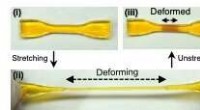 Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore -
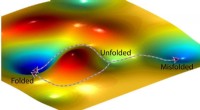 Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre
Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre -
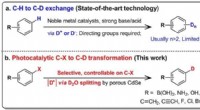 Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore
Præcis deuteration ved hjælp af tungt vandFigur viser sammenligningen mellem den konventionelle H/D-udveksling (baseret på CH-bindinger) og den nye tungvandssplittemetode (baseret på C-X-bindinger). Kredit:National University of Singapore -
 Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter
Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter
- Livscyklus for Minnows
- Kan du virkelig overvinde en oversvømmelse?
- Planetkollisionssimuleringer giver fingerpeg om atmosfærisk tab fra månernes oprindelse
- De fremragende varmeafledningsegenskaber af lagdelte halvledere afsløret ned til ét lag
- Grundstof med oxidationstilstand på -2?
- EU -ledere udsætter afgørelsen om klimamålet i 2050


