Hvilken masse NaCl skulle opløses i 1.000 kg vand hæver kogepunktet med 2,00 grader celsius?
1. Forstå begrebet kogepunkthøjde
Kogepunkthøjde er en kolligativ egenskab, hvilket betyder, at det afhænger af antallet af opløste partikler i en opløsning, ikke den specifikke type opløst stof. Ligningen for kogepunkthøjde er:
ΔT b =i * k b * m
Hvor:
* ΔT b Er kogepunkthøjden (2,00 ° C i dette tilfælde)
* Jeg er Van't Hoff -faktoren, der repræsenterer antallet af ioner, en opløst stof dissocieres i (NaCl dissocieres i 2 ioner:Na⁺ og Cl⁻, så i =2)
* K b er molal kogepunkthøjde konstant for vand (0,512 ° C/m)
* m er molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel)
2. Løs for molalitet (m)
Omarranger ligningen for at løse for molalitet:
M =ΔT B / (i * k b )
M =2,00 ° C / (2 * 0,512 ° C / m)
m =1,953 m
3. Beregn mol af NaCl
Da molalitet er mol -opløst stof pr. Kg opløsningsmiddel, kan vi beregne molen af NaCl:
mol NaCl =molalitet * Mass af opløsningsmiddel (i KG)
mol NaCl =1,953 m * 1.000 kg
mol NaCl =1,953 mol
4. Konverter mol til gram
Brug den molære masse af NaCI (58,44 g/mol) til at konvertere mol til gram:
Masse NaCl =mol NaCl * Molær masse NaCl
Masse NaCl =1,953 mol * 58,44 g/mol
Masse NaCl ≈ 114 g
Derfor skal ca. 114 gram NaCl opløses i 1.000 kg vand for at hæve kogepunktet med 2,00 grader Celsius.
 Varme artikler
Varme artikler
-
 Kemikere løser vedvarende problem efter fire årtierKredit:Leiden University Efter næsten fire årtier, Leider og Eindhoven kemikere har løst diskussionen om den korrekte model vedrørende den enkleste kemiske reaktion i heterogen katalyse, som er af
Kemikere løser vedvarende problem efter fire årtierKredit:Leiden University Efter næsten fire årtier, Leider og Eindhoven kemikere har løst diskussionen om den korrekte model vedrørende den enkleste kemiske reaktion i heterogen katalyse, som er af -
 Højfølsomme nanofotoniske sensorer med passiv indfangning af analytmolekyler i hot-spotsØverst:skematisk af det optiske sensordesign med fangede molekyler. Nederst:skematisk, der viser processen med at koncentrere og fange molekyler i en opløsning. Kredit:Xianglong Miao, Lingyue Yan, Yun
Højfølsomme nanofotoniske sensorer med passiv indfangning af analytmolekyler i hot-spotsØverst:skematisk af det optiske sensordesign med fangede molekyler. Nederst:skematisk, der viser processen med at koncentrere og fange molekyler i en opløsning. Kredit:Xianglong Miao, Lingyue Yan, Yun -
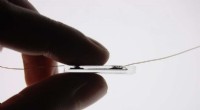 Strækbare og klemme bløde sensorer et skridt nærmere takket være den nye bindingsmetodeEn sensor holdt mellem to fingre. Kredit:Michael Kasimatis Bioingeniører fra Imperial College London har fundet en måde at skabe elastiske og squeezy bløde sensorenheder ved at binde gummi til ele
Strækbare og klemme bløde sensorer et skridt nærmere takket være den nye bindingsmetodeEn sensor holdt mellem to fingre. Kredit:Michael Kasimatis Bioingeniører fra Imperial College London har fundet en måde at skabe elastiske og squeezy bløde sensorenheder ved at binde gummi til ele -
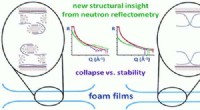 Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o
Skål! Forskere tager et stort skridt i retning af at lave det perfekte hoved af ølKredit: Kemisk kommunikation (2019). DOI:10.1039/C9CC08470C Drikkere vil snart juble hele vejen til baren takket være et team af forskere, der har taget et stort skridt fremad med at løse gåden o
- Hvad kan forårsage en midlertidig dipol i et atom?
- Hvor lang tid tager jorden at rejse rundt i solen?
- 'Mørke stjerner':Mørkt stof kan danne eksploderende stjerner, og observation af skaden kan hjælpe…
- Hastigheden af fotosyntesen øges, når koncentrationens brintgas øges?
- Hvad er en felsisk påtrængende klippe?
- Hvordan umulige farver (som Stygian Blue) virker


