Hvad sker der, når zink og ilt kombineres?
Her er en sammenbrud af, hvad der sker:
* zink (Zn) er et metal, der er relativt reaktivt.
* ilt (O2) er en meget reaktiv gas.
* Når zink udsættes for ilt, reagerer oxygenatomerne med zinkatomerne.
* Hvert zinkatom mister to elektroner til dannelse af en zinkion (zn²⁺) .
* Hvert iltmolekyle får fire elektroner til dannelse af to oxidioner (O²⁻) .
* Disse ioner kombineres derefter til dannelse af zinkoxid (ZnO) , et hvidt fast stof.
Den kemiske ligning for denne reaktion er:
2 Zn + O2 → 2 Zno
egenskaber ved zinkoxid:
Zinkoxid er et hvidt, lugtfrit pulver, der er vidt brugt i forskellige brancher, herunder:
* maling og belægninger For dets pigment og beskyttelsesegenskaber
* kosmetik Som solcreme og antiinflammatorisk middel
* gummiindustri Som en forstærknings- og vulkaniserende agent
* Medicin For dets antibakterielle og antifungale egenskaber
Bemærk:
Reaktionen mellem zink og ilt kan forekomme ved stuetemperatur, men den accelereres af varme. Når zink opvarmes i nærvær af ilt, forbrænder den med en lys, hvid flamme, der producerer zinkoxid som en hvid røg.
 Varme artikler
Varme artikler
-
 Mere solenergi takket være titaniumKredit:Wiley Jord rigeligt, billige metaller er lovende fotokatalytiske elektrodematerialer i kunstig fotosyntese. Et hold kinesiske forskere rapporterer nu, at et tyndt lag titaniumdioxid under h
Mere solenergi takket være titaniumKredit:Wiley Jord rigeligt, billige metaller er lovende fotokatalytiske elektrodematerialer i kunstig fotosyntese. Et hold kinesiske forskere rapporterer nu, at et tyndt lag titaniumdioxid under h -
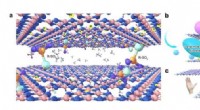 Ny membran adskiller spejlede molekyler effektivtIllustration af den chirale membran til selektiv permeation. Kredit:LIU Bos team Prof. Liu Bo og kolleger ved University of Science and Technology of China (USTC) har udviklet en chiral separation
Ny membran adskiller spejlede molekyler effektivtIllustration af den chirale membran til selektiv permeation. Kredit:LIU Bos team Prof. Liu Bo og kolleger ved University of Science and Technology of China (USTC) har udviklet en chiral separation -
 Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky
Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky -
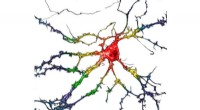 Forskere identificerer et psykedelisk lignende stof uden de hallucinogene bivirkningerEt repræsentativt billede af dyrkede dissocierede hippocampusneuroner, der midlertidigt udtrykker psychLight1 og psychLight2. Skala bar, 20 mm. Kredit:Calvin Ly Psykedeliske lægemidler har vist lø
Forskere identificerer et psykedelisk lignende stof uden de hallucinogene bivirkningerEt repræsentativt billede af dyrkede dissocierede hippocampusneuroner, der midlertidigt udtrykker psychLight1 og psychLight2. Skala bar, 20 mm. Kredit:Calvin Ly Psykedeliske lægemidler har vist lø
- Sådan bukker du fladt glas perfekt rundt om hjørner
- Syntetiseret mikroporøst 3D-grafenlignende carbonatomer
- Kæmpe jordskælv afslører problemer med, hvordan New Zealand forbereder sig
- Hvilken kraft ville forhindre en bold i at rulle?
- Selv når de inkluderer dem, begavede programmer tjener ikke sorte børn eller børn med lav indkoms…
- Papirhøjdepunkt:Solvent-medieret ende-til-ende-samling af guldnanoroder


