Beregn kogepunktforhøjelsen af en saltvandopløsning, der indeholder 3,40 g NaCl opløst i 148 ml vand?
1. Beregn molaliteten af opløsningen:
* Molær masse af NaCl: 58,44 g/mol
* mol NaCl: (3,40 g NaCl) / (58,44 g / mol) =0,0582 mol NaCl
* vandmasse (i kg): 148 ml * (1 g/ml) * (1 kg/1000 g) =0,148 kg
* molalitet (m): (0,0582 mol NaCl) / (0,148 kg vand) =0,393 mol / kg
2. Beregn kogepunkthøjden:
* kogepunktstigning konstant (KB) til vand: 0,512 ° C/m
* Van't Hoff Factor (I) for NaCl: 2 (NaCl dissocieres i 2 ioner i opløsning:Na+ og Cl-)
* kogepunkthøjde (ΔTB): I * kb * m =2 * 0,512 ° C/m * 0,393 mol/kg =0,404 ° C
3. Bestem det nye kogepunkt:
* Normalt kogepunkt af vand: 100 ° C.
* Nyt kogepunkt: 100 ° C + 0,404 ° C = 100,404 ° C
Derfor er kogepunktforhøjelsen af saltvandopløsningen 0,404 ° C, og det nye kogepunkt er 100,404 ° C.
Sidste artikelEr nedbrydningsreaktion en kemisk reaktion?
Næste artikelHar platin et lavt smeltepunkt?
 Varme artikler
Varme artikler
-
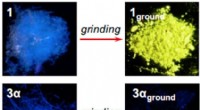 Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ
Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes9-anthryl guld(I) isocyanid (3α) bliver usynligt og udsender infrarødt efter det er malet, mens phenylguld(I) isocyanid (1) bliver gult. Kredit:Seki T. et al., Journal of the American Chemical Societ -
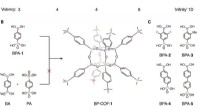 Ny kovalent organisk ramme, der bruger bor og fosfor, giver mulighed for bedre tilslutningHøjere valens i COFer og syntetisk strategi for polycubaner. (A) Bygningsenheder med valens 3 og 4 bruges i øjeblikket i design og syntese af 3D COFer; terninger med valens på 8 og uendelige 1D-stænge
Ny kovalent organisk ramme, der bruger bor og fosfor, giver mulighed for bedre tilslutningHøjere valens i COFer og syntetisk strategi for polycubaner. (A) Bygningsenheder med valens 3 og 4 bruges i øjeblikket i design og syntese af 3D COFer; terninger med valens på 8 og uendelige 1D-stænge -
 Forskere systematiserer metoderne til syntese af azocinholdige systemerKredit:Open Chemistry Database Søgen efter syntetiske veje for nye lægemidler spiller en ekstremt vigtig rolle i nutidig medicinsk kemi. Organiske kemikere fra Rusland gennemførte en systematisk u
Forskere systematiserer metoderne til syntese af azocinholdige systemerKredit:Open Chemistry Database Søgen efter syntetiske veje for nye lægemidler spiller en ekstremt vigtig rolle i nutidig medicinsk kemi. Organiske kemikere fra Rusland gennemførte en systematisk u -
 Smarte simuleringer kortlægger adfærden hos overraskende strukturerMultistabile metamaterialer. Kredit:AMOLF AMOLF-forskere studerer tredimensionelle prismatiske strukturer, der kan antage forskellige former med det formål at producere metamaterialer, der har fle
Smarte simuleringer kortlægger adfærden hos overraskende strukturerMultistabile metamaterialer. Kredit:AMOLF AMOLF-forskere studerer tredimensionelle prismatiske strukturer, der kan antage forskellige former med det formål at producere metamaterialer, der har fle
- Hvor mange atomer er der i formlen HNO3 (salpetersyre)?
- Anskaffelse af kanaltilstandsinformation til mmWave MIMO:Traditionelle og maskinlæringstilgange
- Er luft, der modstår lodret bevægelse, der er beskrevet som stabil?
- Sådan fjernes Field Fields
- Hvad er metoden til at finde breddegrad og længdegradshøjde af punkter på jordoverfladen ved hjæ…
- Ville du forvente at se foldede bjerge rækkevidde ved Mid Ocean Ridges?


