Hvor meget CO2 dannes ved forbrænding af 1,8 kg oktan?
1. Skriv den afbalancerede kemiske ligning:
Forbrændingen af octan (C₈H₁₈) producerer kuldioxid (CO₂) og vand (H₂O):
2 C₈H₁₈ + 25 O₂ → 16 CO₂ + 18 H₂O
2. Konverter masse af oktan til mol:
* Molmasse Octane (C₈H₁₈) =114,23 g/mol
* 1,8 kg oktan =1800 g oktan
* Mol octan =(1800 g) / (114,23 g / mol) =15,75 mol
3. Brug molforhold fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 2 mol octan producerer 16 mol kuldioxid.
* Mol co₂ =(15,75 mol octane) * (16 mol co₂ / 2 mol octan) =126 mol co₂
4. Konverter mol co₂ til masse:
* Molmasse CO₂ =44,01 g/mol
* Mass af co₂ =(126 mol) * (44,01 g/mol) =5545,26 g
* Konverter gram til kilogram:5545,26 g =5,545 kg
Derfor dannes ca. 5,545 kg CO₂ fra forbrænding af 1,8 kg oktan.
 Varme artikler
Varme artikler
-
 Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p
Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p -
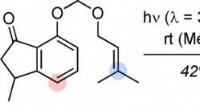 Total syntese af sesquiterpen agarozizanol BKredit:Wiley Med udgangspunkt i tilgængelige kemikalier, et tysk team af forskere gennemførte med succes den totale syntese af agarozizanol B, et interessant naturligt stof, der findes i agartræ.
Total syntese af sesquiterpen agarozizanol BKredit:Wiley Med udgangspunkt i tilgængelige kemikalier, et tysk team af forskere gennemførte med succes den totale syntese af agarozizanol B, et interessant naturligt stof, der findes i agartræ. -
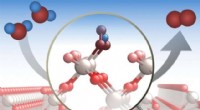 Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor -
 Ny polymer fremstillingsproces sparer 10 størrelsesordener af energiUniversity of Illinois forskere Philippe Geubelle, venstre, Scott White, Nancy Sottos og Jeffrey Moore har udviklet en ny polymerhærdningsproces, der kan reducere mængden af tid og energi, der forbr
Ny polymer fremstillingsproces sparer 10 størrelsesordener af energiUniversity of Illinois forskere Philippe Geubelle, venstre, Scott White, Nancy Sottos og Jeffrey Moore har udviklet en ny polymerhærdningsproces, der kan reducere mængden af tid og energi, der forbr
- Hvordan genekspressionsstøj former celleskæbne
- 3D-billedundersøgelse afslører, hvordan atomer er pakket i amorfe materialer
- Hvordan man opfylder elevernes mangfoldighedsmål og samtidig giver forældrene indflydelse på, hvo…
- The Ramanujan Machine:Forskere har udviklet en formodningsgenerator, der skaber matematiske formodni…
- Sådan konverteres en skrå højde til en normal højde
- Nyt granatæble-inspireret design løser problemer for lithium-ion-batterier


