Hvad sker der, hvis en kemisk reaktion finder sted i et åbent system?
Nøgleegenskaber ved åbne systemer
* udveksling af stof: Åbne systemer kan frit udveksle stof med deres omgivelser. Dette betyder, at reaktanter kan tilføjes, og produkter kan undslippe.
* ENSENCE: Åbne systemer udveksler også energi (varme og/eller arbejde) med deres miljø.
Konsekvenser for kemiske reaktioner
1. Produkttab: Hvis produkterne fra reaktionen er gasser eller flygtige væsker, kan de flygte ud i atmosfæren. Dette vil reducere udbyttet af reaktionen.
2. reaktantudtømning: Hvis reaktanter ikke kontinuerligt leveres, vil reaktionen til sidst stoppe, når reaktanter forbruges.
3. Temperaturændringer: Reaktionen kan frigive eller absorbere varme, ændre temperaturen på systemet og potentielt påvirke reaktionshastigheden.
4. trykændringer: Hvis gasser er involveret, kan ændringer i tryk påvirke reaktionens ligevægt.
5. ligevægtsskift: Tabet af produkter eller reaktanter i et åbent system vil forstyrre ligevægt af reversible reaktioner. Reaktionen skifter til at favorisere produktionen af flere produkter eller reaktanter, afhængigt af hvilken komponent der går tabt.
Eksempler
* forbrænding af et lys: Flammen er et åbent system. Voks forbruges (reaktant), og kuldioxid, vanddamp og lys frigøres (produkter). Varme frigøres også, hvilket påvirker forbrændingshastigheden.
* kogende vand: Vanddamp slipper ud af gryden (produkttab). Varmen fra komfuret driver reaktionen fremad.
faktorer, der påvirker åbne systemer
* reaktionsbetingelser: Den specifikke reaktions temperatur, tryk og katalysator tilstedeværelse påvirker reaktionshastigheden og udbyttet.
* Omgivende miljø: Betingelserne uden for systemet (temperatur, tryk, sammensætning af omgivende luft eller væske) kan påvirke reaktionen markant.
Key Takeaway:
Åbne systemer introducerer kompleksiteter til kemiske reaktioner, fordi de giver mulighed for interaktion med miljøet. At forstå, hvordan stof og energiudveksling med omgivelserne er afgørende for at forudsige og kontrollere resultatet af reaktioner.
 Varme artikler
Varme artikler
-
 Forskere opdager superelastisk formhukommelsesmaterialeMaterialevidenskab og ingeniørprofessor Seok-Woo Lee og kolleger har opdaget superelastiske formhukommelsesegenskaber i et materiale, der kunne bruges under de hårdeste forhold, såsom det ydre rum. Kr
Forskere opdager superelastisk formhukommelsesmaterialeMaterialevidenskab og ingeniørprofessor Seok-Woo Lee og kolleger har opdaget superelastiske formhukommelsesegenskaber i et materiale, der kunne bruges under de hårdeste forhold, såsom det ydre rum. Kr -
 Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f
Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f -
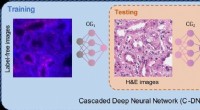 Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr
Kemikaliefri genfarvning af væv ved hjælp af dyb læringVirtuel genfarvning af væv ved hjælp af kaskadede dybe neurale netværk. Kredit:Ozcan Lab @ UCLA. Vævsbaseret diagnosticering af sygdomme er afhængig af den visuelle inspektion af biopsierede vævspr -
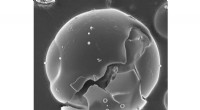 Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere
Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere
- Hvorfor Einstein tog fejl i at være
- Konstruktion af et symbiotisk forhold mellem E. coli og stinkbugs afslører spor om, hvordan symbios…
- Hvordan ville de spektrale linjer i en stjerne ændre sig, når de bevæger sig nærmere på Jorden?…
- Hvad hedder reaktionen mellem syre og en basisk?
- Hvordan danner sedimenter 6. klasse videnskab?
- Sådan beregnes KVA fra KW


