Hvad er forskellen mellem Lithium 6 og Lithum 7 på periodisk tabel?
Her er sammenbruddet:
* lithium-6: Har 3 protoner og 3 neutroner . Dens atommasse er cirka 6.
* lithium-7: Har 3 protoner og 4 neutroner . Dens atommasse er cirka 7.
Nøgleforskelle:
* Masse: Lithium-7 er tungere end lithium-6 på grund af den ekstra neutron.
* Naturlig overflod: Lithium-7 er meget mere rigelig i naturen (92,5%) end Lithium-6 (7,5%).
* nukleare egenskaber: Lithium-6 bruges i nukleare fusionsreaktioner, mens Lithium-7 bruges i medicinsk billeddannelse og terapi.
Periodisk tabel:
Den periodiske tabel viser kun gennemsnittet atommasse af lithium, som er cirka 6,941. Dette gennemsnit afspejler den relative forekomst af de to isotoper.
Kortfattet:
Forskellen mellem lithium-6 og lithium-7 ligger i deres neutronantal, hvilket påvirker deres masse og nogle af deres nukleare egenskaber. Mens den periodiske tabel ikke skelner mellem isotoper, er det vigtigt at forstå, at elementer kan eksistere i forskellige isotopiske former.
Sidste artikelHvad sker der, hvis en kemisk reaktion finder sted i et åbent system?
Næste artikelEr kulstof et metal eller gas?
 Varme artikler
Varme artikler
-
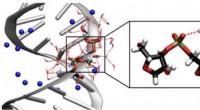 Fleksibilitet og arrangement - samspillet mellem ribonukleinsyre og vandTil venstre er en struktur af en RNA dobbelt helix. De blå kugler repræsenterer natriummodioner. Til højre er et forstørret segment af sukker-phosphat-rygraden af RNA, herunder brodannende vandmolek
Fleksibilitet og arrangement - samspillet mellem ribonukleinsyre og vandTil venstre er en struktur af en RNA dobbelt helix. De blå kugler repræsenterer natriummodioner. Til højre er et forstørret segment af sukker-phosphat-rygraden af RNA, herunder brodannende vandmolek -
 Kollagen kan modstå flere belastninger end hidtil kendtKredit:CC0 Public Domain Forskere ved Institut for Fysik ved Kings College i London har opdaget, at kollagenfibriller kan modstå en væsentlig større belastning end tidligere antaget, udvide vores
Kollagen kan modstå flere belastninger end hidtil kendtKredit:CC0 Public Domain Forskere ved Institut for Fysik ved Kings College i London har opdaget, at kollagenfibriller kan modstå en væsentlig større belastning end tidligere antaget, udvide vores -
 Forskere finder molekylær ødelæggelseskode for enzym involveret i kolesterolproduktionUNSW ph.d.-kandidat Jake Chua er hovedforfatter på et papir, der viser, hvordan et nøgleenzym, der bidrager til kolesterolproduktion, kan reguleres - og ødelægges - ved hjælp af et bestemt molekyle. K
Forskere finder molekylær ødelæggelseskode for enzym involveret i kolesterolproduktionUNSW ph.d.-kandidat Jake Chua er hovedforfatter på et papir, der viser, hvordan et nøgleenzym, der bidrager til kolesterolproduktion, kan reguleres - og ødelægges - ved hjælp af et bestemt molekyle. K -
 Elektrostatisk kraft tager ansvaret i bioinspirerede polymererInspireret af principperne for naturlig polymersyntese, Illinois kemisk og biomolekylær ingeniør professor Charles Sing, venstre, og kandidatstuderende Jason Madinya og Tyler Lytle var medforfatter ti
Elektrostatisk kraft tager ansvaret i bioinspirerede polymererInspireret af principperne for naturlig polymersyntese, Illinois kemisk og biomolekylær ingeniør professor Charles Sing, venstre, og kandidatstuderende Jason Madinya og Tyler Lytle var medforfatter ti
- En plan for livsformer på Mars?
- At bryde absorptionsgrænsen for silicium mod det korte bølgelængde infrarøde bølgelængdeområd…
- Nyt fundet fænomen, der kan forbedre orkanprognoser
- Jernkarbonater i jordens kappe hjælper med at danne diamanter
- Hvilken type energi producerer en motorsav?
- Hvordan korrigerer du håndledsbegrænsninger med ergonomi?


