Fleksibilitet og arrangement - samspillet mellem ribonukleinsyre og vand
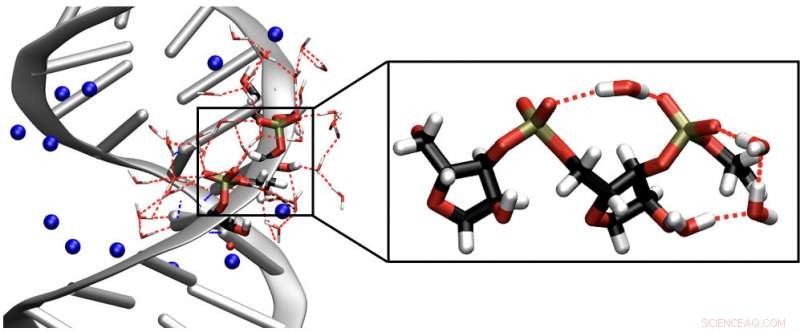
Til venstre er en struktur af en RNA dobbelt helix. De blå kugler repræsenterer natriummodioner. Til højre er et forstørret segment af sukker-phosphat-rygraden af RNA, herunder brodannende vandmolekyler. Vibrationer af RNA-rygraden tjener som følsomme realtidsprober til kortlægning af nabovandmolekylernes indflydelse på RNA's struktur og dynamik. Kredit:MBI
Ribonukleinsyre (RNA) spiller en nøglerolle i biokemiske processer, der forekommer på celleniveau i et vandmiljø. Mekanismer og dynamikker i interaktionen mellem RNA og vand blev nu afsløret ved vibrationsspektroskopi på ultrakorte tidsskalaer og analyseret ved dybdegående teori.
Ribonukleinsyre (RNA) repræsenterer en elementær bestanddel af biologiske celler. Mens deoxyribonukleinsyre (DNA) tjener som bærer af genetisk information, RNA viser en meget mere kompleks biokemisk funktionalitet. Dette inkluderer transmission af information i form af mRNA, RNA-medieret katalytisk funktion i ribosomer, og indkodning af genetisk information i vira. RNA består af en sekvens af organiske nukleobasemolekyler holdt sammen af en såkaldt rygrad bestående af fosfat- og sukkergrupper. En sådan sekvens kan eksistere som en enkelt streng eller i en parret dobbelthelixgeometri. Begge former er indlejret i en vandskal, og deres fosfat- og sukkergrupper er forskellige dockingpunkter for vandmolekyler. Vandskallens struktur svinger på en tidsskala på nogle få tiendedele af et picosekund. Interaktionerne mellem RNA og vand og deres rolle for dannelsen af tredimensionelle RNA-strukturer forstås kun utilstrækkeligt og vanskeligt tilgængelige ved eksperiment.
Forskere fra Max Born Institute har nu observeret interaktionen mellem RNA og dens vandskal i realtid. I deres nye eksperimentelle metode, vibrationer af RNA-rygraden tjener som følsomme ikke-invasive prober for indflydelsen af nabovandmolekyler på strukturen og dynamikken af RNA. Den såkaldte todimensionelle infrarøde spektroskopi gør det muligt at kortlægge tidsudviklingen af vibrationsexcitationer og bestemme molekylære interaktioner inden for RNA og mellem RNA og vand. Resultaterne viser, at vandmolekyler ved RNA-overfladen udfører vippebevægelser, såkaldte librationer, inden for en brøkdel af et picosekund, hvorimod deres lokale rumlige arrangement bevares i et tidsinterval længere end 10 ps. Denne adfærd afviger kraftigt fra den for rent vand og er styret af de steriske grænsebetingelser sat af RNA-overfladen. Individuelle vandmolekyler forbinder tilstødende fosfatgrupper og danner en delvis ordnet struktur, som medieres af deres kobling til sukkerenhederne.
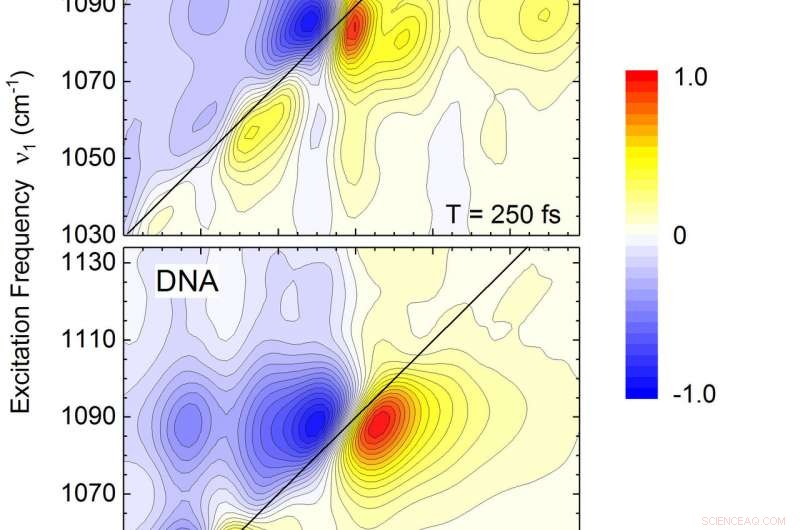
De todimensionelle vibrationsspektre af RNA (øverste panel) og DNA (nedre panel) i frekvensområdet for sukker-phosphat-vibrationerne i rygraden. RNA-spektret viser yderligere bånd (konturer) langs frekvensdiagonalen ν1=ν3 og en mere kompleks fordeling af off-diagonale toppe. Ud over frekvenspositionerne giver linjeformerne af de enkelte bånd (konturer) indsigt i detaljer om interaktioner med nabovandmolekyler. Kredit:MBI
De frigørende vandmolekyler genererer en elektrisk kraft, hvorved vandsvingningerne overføres til RNA's vibrationer. De forskellige rygradsvibrationer udviser en forskelligartet dynamisk adfærd, som er bestemt af deres lokale vandmiljø og afspejler dets heterogenitet. RNA-vibrationer kobles også indbyrdes og udveksler energi indbyrdes og med vandskallen. Den resulterende ultrahurtige omfordeling af overskydende energi er afgørende for at undgå en lokal overophedning af den følsomme makromolekylære struktur. Dette komplekse scenarie blev analyseret ved hjælp af detaljerede teoretiske beregninger og simuleringer, som, blandt andre resultater, tilladt for den første fuldstændige og kvantitative identifikation af de forskellige vibrationer i RNA-rygraden. Sammenlignende eksperimenter med DNA afslører ligheder og karakteristiske forskelle mellem disse to elementære biomolekyler, viser et mere struktureret vandarrangement omkring RNA. Undersøgelsen fremhæver det stærke potentiale af ikke-invasiv tidsopløst vibrationsspektroskopi til at optrevle samspillet mellem struktur og dynamik i komplekse biomolekylære systemer på molekylær længde og tidsskala.
 Varme artikler
Varme artikler
-
 Undersøgelse afslører, hvordan sårfremkaldende bakterier overlever i mavenKredit:University of Western Australia Forskere ved University of Western Australia, i samarbejde med forskere ved Imperial College London og Perth-baserede biotek Ondek Pty Ltd, har afsløret ny i
Undersøgelse afslører, hvordan sårfremkaldende bakterier overlever i mavenKredit:University of Western Australia Forskere ved University of Western Australia, i samarbejde med forskere ved Imperial College London og Perth-baserede biotek Ondek Pty Ltd, har afsløret ny i -
 Undersøgelse giver gennembrud i forståelsen af fejl i højtydende fibreInteriøret i en højtydende ballistisk fiber, illustrerer det komplekse hierarki inden for. Splittet fiber udviser brofunktioner, varierer i størrelse fra nanoskala til mikroskala, der giver ny indsigt
Undersøgelse giver gennembrud i forståelsen af fejl i højtydende fibreInteriøret i en højtydende ballistisk fiber, illustrerer det komplekse hierarki inden for. Splittet fiber udviser brofunktioner, varierer i størrelse fra nanoskala til mikroskala, der giver ny indsigt -
 Blæksprutteskind inspirerer til skabelsen af næste generations rumtæppeAlon Gorodetsky, UCI lektor i kemisk og biomolekylær teknik, og Erica Leung, en UCI kandidatstuderende i den afdeling, har opfundet et nyt materiale, der kan fange eller frigive varme efter ønske. Kre
Blæksprutteskind inspirerer til skabelsen af næste generations rumtæppeAlon Gorodetsky, UCI lektor i kemisk og biomolekylær teknik, og Erica Leung, en UCI kandidatstuderende i den afdeling, har opfundet et nyt materiale, der kan fange eller frigive varme efter ønske. Kre -
 Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland
Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland
- Børns trivsel påvirkes ikke negativt af at bo i enlige forsørgere, undersøgelse viser
- Nyt teleskop jager mysterierne med radioblink og mørk energi
- Uber viser en stor stigning i regeringens anmodninger om rytteroplysninger
- Dopingkrystaller af nanokrystaller
- Forskere undersøger kemien i en enkelt batterielektrodepartikel både inde og ude
- ExoMars orbiter fortsætter jagten efter nøgletegn på liv på Mars


