Er fosfor en meget reaktiv ikke-metal?
* Elektronkonfiguration: Fosfor har 5 valenselektroner, hvilket betyder, at det kun behøver at vinde 3 mere for at opnå en stabil oktet. Dette gør det meget reaktivt.
* allotropes: Fosfor findes i flere allotropiske former, hvor hvidt fosfor er den mest reaktive. Hvidt fosfor er meget brandfarligt og reagerer let med ilt.
* reaktioner med ilt: Fosfor reagerer let med ilt for at danne fosforoxider, hvilket frigiver en betydelig mængde varme og lys.
* reaktioner med halogener: Fosfor reagerer kraftigt med halogener til dannelse af fosforhalogenider.
* reaktioner med metaller: Fosfor danner fosfider med metaller, der viser dens reaktive natur.
Det er dog vigtigt at bemærke:
* rødt fosfor: Rød fosfor, en anden allotrop, er meget mindre reaktiv end hvidt fosfor. Det bruges i kampe og andre applikationer på grund af dens kontrollerede reaktivitet.
Kortfattet: Fosfor er en meget reaktiv ikke-metal på grund af dens elektronkonfiguration, hvilket gør den tilbøjelig til at danne forbindelser med andre elementer. Dens reaktivitet kan imidlertid kontrolleres af dens allotropiske former.
 Varme artikler
Varme artikler
-
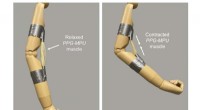 Højenergi formhukommelsespolymer kunne en dag hjælpe robotter med at bøje deres musklerEn kunstig muskel lavet af en strakt formhukommelsespolymer trækker sig sammen ved opvarmning, bøjer en mannequin arm. Kredit:Tilpasset fra ACS Central Science 2021, DOI:10.1021/acscentsci.1c00829
Højenergi formhukommelsespolymer kunne en dag hjælpe robotter med at bøje deres musklerEn kunstig muskel lavet af en strakt formhukommelsespolymer trækker sig sammen ved opvarmning, bøjer en mannequin arm. Kredit:Tilpasset fra ACS Central Science 2021, DOI:10.1021/acscentsci.1c00829 -
 Sjældent jernmineral fra sten fundet i bløddyrstænderScanning elektronmikroskop billede af den forreste ende af radula med modne tænder. Kredit:Northwestern University Northwestern University forskere har, for første gang, opdagede et sjældent miner
Sjældent jernmineral fra sten fundet i bløddyrstænderScanning elektronmikroskop billede af den forreste ende af radula med modne tænder. Kredit:Northwestern University Northwestern University forskere har, for første gang, opdagede et sjældent miner -
 Bedre vurdering af bakteriers følsomhed over for antibiotika kan ændre, hvordan lægemidler ordine…En mikrochip-antibiotisk testplatform, der reducerer den nødvendige tid til at identificere den rigtige medicin, udviklet af forskere ved Korea Advanced Institute of Science and Technology. Kredit:Jeo
Bedre vurdering af bakteriers følsomhed over for antibiotika kan ændre, hvordan lægemidler ordine…En mikrochip-antibiotisk testplatform, der reducerer den nødvendige tid til at identificere den rigtige medicin, udviklet af forskere ved Korea Advanced Institute of Science and Technology. Kredit:Jeo -
 Skatteregel for industrien belønner kulstofopsamlingKredit:CC0 Public Domain Når det kommer til at tilskynde producenter til at reducere deres kuldioxid (CO 2 ) emissioner, en gulerod kan være mere effektiv end en pind. Det er den tilgang, der er
Skatteregel for industrien belønner kulstofopsamlingKredit:CC0 Public Domain Når det kommer til at tilskynde producenter til at reducere deres kuldioxid (CO 2 ) emissioner, en gulerod kan være mere effektiv end en pind. Det er den tilgang, der er


