Hvilken base er en svag elektrolyt A. natriumhydroxid B. kalium C. calcium D. ammoniak?
* svage elektrolytter: Disse stoffer ioniserer kun delvist (bryder sammen i ioner), når de opløstes i vand. Dette betyder, at de fører elektricitet svagt.
* stærke elektrolytter: Disse stoffer ioniserer sig fuldt ud i vand, hvilket fører til stærk ledningsevne.
Lad os analysere indstillingerne:
* a. Natriumhydroxid (NaOH): En stærk base, ioniserer fuldt ud i vand.
* b. Kalium (K): Et metal danner let ioner i vand.
* c. Calcium (CA): Et metal danner let ioner i vand.
* d. Ammoniak (NH₃): En svag base. Mens det reagerer med vand for at danne nogle hydroxidioner (OH⁻), ioniserer det ikke fuldstændigt.
Kortfattet: Ammoniak er det eneste stof, der er anført, der er en svag elektrolyt på grund af dens delvis ionisering i vand.
Sidste artikelEr fosfor en meget reaktiv ikke-metal?
Næste artikelHvad har du brug for for at få en kemisk reaktion?
 Varme artikler
Varme artikler
-
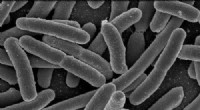 25-minutters test kunne forenkle indledende diagnose af urinvejsinfektioner, bekæmpe antibiotikares…Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Biologiske ingeniører ved University of Bath har udviklet en test, der kan hjælpe læger med hurtigt at diagnosticere urinvejsinfekt
25-minutters test kunne forenkle indledende diagnose af urinvejsinfektioner, bekæmpe antibiotikares…Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Biologiske ingeniører ved University of Bath har udviklet en test, der kan hjælpe læger med hurtigt at diagnosticere urinvejsinfekt -
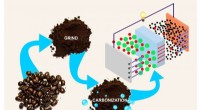 Kemikere syntetiserer elektroder til akkumulatorer fra kaffegrumsKredit:Natalia Deryugina En kemiker fra RUDN foreslog en billig og miljøvenlig måde at fremstille elektroder til lithium-ion-batterier fra kaffeproduktionsaffald. En artikel, der beskriver denne u
Kemikere syntetiserer elektroder til akkumulatorer fra kaffegrumsKredit:Natalia Deryugina En kemiker fra RUDN foreslog en billig og miljøvenlig måde at fremstille elektroder til lithium-ion-batterier fra kaffeproduktionsaffald. En artikel, der beskriver denne u -
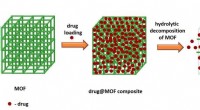 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu -
 Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
Levende cellemembraner kan selvsortere deres komponenter ved afblandingFaseadskillelse i en syntetisk membran. Kredit:Caitlin Cornell/University of Washington Celler - byggestenene i vores kroppe - er indkapslet af membraner. Det samme gælder de specialiserede rum i
- Betragtes solen som en plante eller stjerne?
- Et topografisk kort indikerer, at en hældning er meget stejl ved at bruge?
- Forskere udvikler lagdelt koboltoxid med en rekordhøj termoelektrisk værdi
- Ny mobilapp til sundere madvalg, når du spiser ude
- Hvad er nettoafgiften for et ikke-ioniseret atom?
- Løbende stjerne – ud af mørkets galaktiske hjerte som en flagermus ud af helvede


