Hvad sker der, når svovl forbrænder for at fremstille dioxid?
Her er en sammenbrud af processen:
reaktion:
* svovl (r) + ilt (O2) → Svovldioxid (SO2)
Hvad sker der:
1. forbrænding: Svovl reagerer med iltmolekyler i luften.
2. Energifrigivelse: Denne reaktion frigiver varme og lys, hvilket får svovl til at brænde.
3. Dannelse af svovldioxid: Svovlatomerne kombineres med iltatomer for at danne svovldioxidmolekyler.
egenskaber ved svovldioxid:
* farveløs gas: Det er usynligt for det blotte øje.
* skarp lugt: Det har en skarp, kvælende lugt.
* giftig: Svovldioxid er en luftvejsirritant og kan være skadelig for menneskers sundhed.
* Acid Rain Precursor: Når det frigives i atmosfæren, reagerer svovldioxid med vanddamp til dannelse af svovlsyre, hvilket bidrager til surt regn.
Praktiske applikationer:
* Industrielle processer: Svovldioxid anvendes til produktion af svovlsyre, som er en afgørende ingrediens i mange brancher.
* Fødevarekonservering: Det bruges som en fumigant og et konserveringsmiddel til tørrede frugter og grøntsager.
Det er vigtigt at bemærke, at forbrænding af svovl til at producere svovldioxid er en betydelig kilde til luftforurening. Derfor er det vigtigt at minimere svovlemissioner fra industrielle processer og at finde alternative metoder til at producere svovlsyre.
Sidste artikelHvad er sammensat til AII3?
Næste artikelFra hvilken orbital i et lithiumatom er et elektron overført til dannelse af li ion?
 Varme artikler
Varme artikler
-
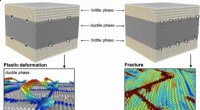 Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f
Foreslået ingeniørmetode kunne bidrage til at gøre bygninger og broer sikrereGrænseflade-dislokationskontrolleret deformation og fraktur i nanolagskompositter. Afstanden mellem grænsefladeforskydninger, som optager misfit-belastning mellem ferrit- og cementitfasen, bestemmer f -
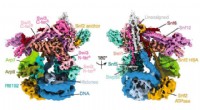 Forskere kortlægger strukturen af det centrale kromatin-ombygningskompleksKredit:Northwestern University Northwestern University-forskere har kortlagt en gruppe proteiner, der spiller en afgørende rolle i både genekspression og reparation af beskadiget DNA. Ved at forst
Forskere kortlægger strukturen af det centrale kromatin-ombygningskompleksKredit:Northwestern University Northwestern University-forskere har kortlagt en gruppe proteiner, der spiller en afgørende rolle i både genekspression og reparation af beskadiget DNA. Ved at forst -
 Vandflasker, andre genbrugte 3-D-printmaterialer kunne undgå forsyningsproblemer fra militæretMed 3D-printere, soldater kunne snart bruge genbrugsflasker og andre affaldsmaterialer til at lave vitale dele, såsom dette bilradiobeslag. Kredit:Nicole Zander/U.S. Hærens forskningslaboratorium
Vandflasker, andre genbrugte 3-D-printmaterialer kunne undgå forsyningsproblemer fra militæretMed 3D-printere, soldater kunne snart bruge genbrugsflasker og andre affaldsmaterialer til at lave vitale dele, såsom dette bilradiobeslag. Kredit:Nicole Zander/U.S. Hærens forskningslaboratorium -
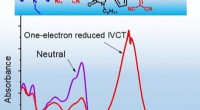 Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
- Hvor langt er den næst tætteste stjerne til Sun?
- Hvilke energiforandringer finder sted, når dreng sparker fodbold?
- Hvad er pH-værdien af let af?
- Ingeniører øger produktionen af solafsaltningssystem med 50 %
- Når et ferromagnetisk materiale er placeret i magnetventilen, kaldes den resulterende enhed en?
- Undersøgelse af fossile rester på øen Sumba afslører enestående skabningshistorie


