Chlor er et meget elektronegativt atom og alligevel CCL4 ikke polær hvorfor kan dette være?
Her er hvorfor:
1. Elektronegativitetsforskel: Klor er meget mere elektronegativ end kulstof. Dette betyder, at elektronerne i C-CL-bindingerne trækkes tættere på kloratomerne, hvilket skaber polære bindinger.
2. molekylær geometri: De fire C-CL-bindinger i CCL4 er arrangeret i en tetrahedral form. Dette symmetriske arrangement betyder, at de individuelle bindingsdipoler (de polære bindinger) annullerer hinanden.
3. netto dipolmoment: Da de individuelle bindingsdipoler annulleres, har molekylet et netto dipolmoment på nul gør det ikke -polært.
Tænk på det sådan: Forestil dig, at du har fire personer, der trækker lige på et reb fra hver retning. De anvender alle kraft, men rebet bevæger sig ikke, fordi kræfterne annullerer. Det samme princip gælder for bindingsdipolerne i CCL4.
Key Takeaway: Selvom et molekyle indeholder polære bindinger, afhænger dens samlede polaritet af dens molekylære geometri. Hvis geometrien er symmetrisk, kan de polære bindinger annullere, hvilket resulterer i et ikke -polært molekyle.
Sidste artikelHvad er tilstanden af stof zink ved 25 grader celsius?
Næste artikelKondenseret strukturel formel af benzylacetat?
 Varme artikler
Varme artikler
-
 Blød og ionledende hydrogel kunstig tunge til astringens opfattelseÆndringer i porestørrelse på mennesketunge efterlignede hydrogel under TA-behandling. (A) SEM-billeder af human tunge efterlignet hydrogel før TA-behandling. (B) Histogram af de gennemsnitlige mikropo
Blød og ionledende hydrogel kunstig tunge til astringens opfattelseÆndringer i porestørrelse på mennesketunge efterlignede hydrogel under TA-behandling. (A) SEM-billeder af human tunge efterlignet hydrogel før TA-behandling. (B) Histogram af de gennemsnitlige mikropo -
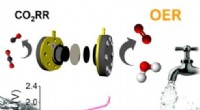 En lav pris, højeffektiv katalysator, der omdanner kuldioxid til andre kemikalierKatalysatoren udviklet af KISTs forskerhold bruger 20 % mindre iridium, et ædelmetal, end eksisterende katalysatorer og viser mindst 31 % højere ydeevne. En langtidstest med brug af postevand blev udf
En lav pris, højeffektiv katalysator, der omdanner kuldioxid til andre kemikalierKatalysatoren udviklet af KISTs forskerhold bruger 20 % mindre iridium, et ædelmetal, end eksisterende katalysatorer og viser mindst 31 % højere ydeevne. En langtidstest med brug af postevand blev udf -
 Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en
Forskere nedbryder plastikaffaldDesign af en sterisk indesluttet bipyridin-ruthenium (Ru) ramme tillader kontrolleret indeslutning af adsorberet H2 og dets levering til inerte amider, hvilket muliggør katalytisk hydrogenering af en -
 Overvågning af korrosion af bioresorberbart magnesiumlegeringer af magnesium, zink og calcium er velegnede til anvendelse som bioresorberbare implantater til at fikse brækkede knogler. Kredit:ETH Zürich ETH-forskere har for nylig været i stand til a
Overvågning af korrosion af bioresorberbart magnesiumlegeringer af magnesium, zink og calcium er velegnede til anvendelse som bioresorberbare implantater til at fikse brækkede knogler. Kredit:ETH Zürich ETH-forskere har for nylig været i stand til a
- En kemisk formel er et udtryk, der bruges til at repræsentere?
- Britisk teenager, der hackede CIA-chefen, får to års fængsel
- Hvordan er bevægelsen af partikel i en væske forskellig fra partikler, der er fast?
- Hvorfor forekommer det andet SQ i accelerationsenheden?
- Hvordan skete jordskøb?
- Unge gener viste sig at tilpasse sig hurtigere end gamle


