Hvis en kobberspole anbringes i opløsning af sølvnitratkrystaller dannes på overfladen, der er meget opløselig genereret?
Her er hvad der sker:
* kobber (CU) er mere reaktiv end sølv (AG). Dette betyder, at kobber let vil opgive sine elektroner for at danne ioner.
* sølvnitrat (AGNO3) er et opløseligt salt. Når det er opløst i vand, danner det sølvioner (Ag+) og nitrationer (NO3-).
* Når en kobberspole anbringes i sølvnitratopløsningen, mister kobberatomerne elektroner og bliver kobberioner (Cu2+). Disse kobberioner går derefter ind i opløsningen.
* På samme tid får sølvioner (AG+) fra opløsningen elektroner og bliver sølvatomer (AG). Disse sølvatomer deponeres på overfladen af kobberspolen og danner de sølvkrystaller, du ser.
Den kemiske ligning for denne reaktion er:
Cu (S) + 2AGNO3 (aq) → Cu (NO3) 2 (aq) + 2ag (s)
Nøglepunkter:
* Reaktionen er spontan Fordi kobber er mere reaktiv end sølv.
* Løsningen bliver blå På grund af tilstedeværelsen af kobber (II) nitrat (Cu (NO3) 2), som er et opløseligt salt.
* De sølvkrystaller, der dannes, er uopløselige i vand.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te
En ny proces til genanvendelse af metallurgisk slaggeKredit:CC0 Public Domain Forskere ved Ural Federal University (UrFU) og Institut for Metallurgi i Ural-afdelingen af Det Russiske Videnskabsakademi (UrB RAS) har udviklet og med succes testet te -
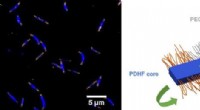 Polymer krystaller er nøglen til rekordstor energitransportBillede, der viser lysemission fra de polymere nanostrukturer og skematisk af en enkelt nanostruktur. Kredit:University of Bristol Forskere fra universiteterne i Bristol og Cambridge har fundet en
Polymer krystaller er nøglen til rekordstor energitransportBillede, der viser lysemission fra de polymere nanostrukturer og skematisk af en enkelt nanostruktur. Kredit:University of Bristol Forskere fra universiteterne i Bristol og Cambridge har fundet en -
 Fra en time til et minut:Ny analyseteknik forenkler processen til at opdage Bisphenol A-forurenende …Kredit:Pixabay/CC0 Public Domain Bisphenol A er en kemisk forbindelse, der hovedsageligt anvendes til fremstilling af plast og til fremstilling af termisk papir, der bruges til at udskrive salgskvi
Fra en time til et minut:Ny analyseteknik forenkler processen til at opdage Bisphenol A-forurenende …Kredit:Pixabay/CC0 Public Domain Bisphenol A er en kemisk forbindelse, der hovedsageligt anvendes til fremstilling af plast og til fremstilling af termisk papir, der bruges til at udskrive salgskvi -
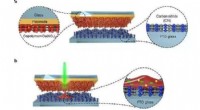 Nanomaterialer med laserprintSådan fungerer den nye laserdrevne metode. Kredit:Max Planck Institute of Colloids and Interfaces I journalen Naturkommunikation , et tværfagligt team fra Max Planck Institute of Colloids and In
Nanomaterialer med laserprintSådan fungerer den nye laserdrevne metode. Kredit:Max Planck Institute of Colloids and Interfaces I journalen Naturkommunikation , et tværfagligt team fra Max Planck Institute of Colloids and In
- Er ler ofte dannet som et resultat af kemisk forvitring?
- Hvordan fungerer en halvlederdiode?
- Vulkansk askesky lukker La Palma lufthavn; ny udluftning dukker op
- Forskere bruger siliciumnanopartikler til bioimaging og lægemiddellevering
- Hvad er den nettoioniske ligning til reaktion af aluminiumhydroxid med en overskydende koncentreret …
- Hvilken subatomisk partikel findes i kernen i alle isotoper brint?


