Hvad er den nettoioniske ligning til reaktion af aluminiumhydroxid med en overskydende koncentreret natriumopløsning?
1. Skriv den afbalancerede molekylære ligning:
AL (OH) ₃ (S) + 3NAOH (AQ) → NA₃AL (OH) ₆ (AQ)
2. Skriv den komplette ioniske ligning:
AL (OH) ₃ (S) + 3NA⁺ (AQ) + 3OH⁻ (AQ) → 3NA⁺ (AQ) + [AL (OH) ₆] ³⁻ (AQ)
3. Identificer og annuller tilskuerioner:
Tilskuerioner er dem, der vises på begge sider af ligningen uændret. I dette tilfælde er tilskuerionen na⁺.
4. Skriv den nettoioniske ligning:
AL (OH) ₃ (S) + 3OH⁻ (aq) → [AL (OH) ₆] ³⁻ (aq)
Forklaring:
* aluminium hydroxid (AL (OH) ₃) er et solidt, så det bryder ikke fra hinanden i ioner.
* natriumhydroxid (NaOH) er en stærk base, der adskiller sig fuldstændigt i opløsning og danner Na⁺ og OH⁻ioner.
* natriumaluminat (Na₃al (OH) ₆) er en kompleks ion, der findes i opløsning.
Den nettoioniske ligning viser, at aluminiumshydroxid reagerer med hydroxidioner for at danne tetrahydroxoaluminat (III) -kompleksion, [AL (OH) ₆] ³⁻.
Nøglepunkter:
* overskydende NaOH: Reaktionen kræver overskydende NaOH for at drive dannelsen af den komplekse ion.
* amfoterisk natur: Aluminiumhydroxid er amfoterisk, hvilket betyder, at det kan reagere med både syrer og baser. I dette tilfælde fungerer det som en syre og accepterer hydroxidioner.
* kompleks iondannelse: Reaktionen danner en kompleks ion, som er en art, der indeholder en central metalion omgivet af ligander (i dette tilfælde hydroxidioner).
 Varme artikler
Varme artikler
-
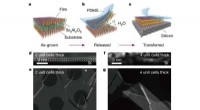 Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und -
 Bærbart kemisæt giver mulighed for testning af bushfoods sødme på stedetUdstyr i kemi værktøjskasse. Kredit:Coopers Plains Labs juni 2021 Oprindelige samfund kan nu vurdere kvaliteten og sødmen af deres vildt høstede indfødte buskfrugter i marken, i stedet for at se
Bærbart kemisæt giver mulighed for testning af bushfoods sødme på stedetUdstyr i kemi værktøjskasse. Kredit:Coopers Plains Labs juni 2021 Oprindelige samfund kan nu vurdere kvaliteten og sødmen af deres vildt høstede indfødte buskfrugter i marken, i stedet for at se -
 Bare bland det sammen:Ny syntetisk metode til fremstilling af amfifile molekyler uden tilsætningsst…Kredit:Dr. Masahiro Yamashina amfifile molekyler, som samler og indkapsler molekyler i vand, finde anvendelse inden for flere felter af kemi. Det enkle, additiv-fri forbindelse af hydrofile og hyd
Bare bland det sammen:Ny syntetisk metode til fremstilling af amfifile molekyler uden tilsætningsst…Kredit:Dr. Masahiro Yamashina amfifile molekyler, som samler og indkapsler molekyler i vand, finde anvendelse inden for flere felter af kemi. Det enkle, additiv-fri forbindelse af hydrofile og hyd -
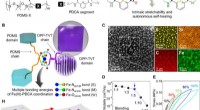 Strækbar, selvhelbredende og halvledende polymerfilm til elektronisk hud (e-skin)Design og karakterisering af belastningsfølsomme, strækbar, og selvhelbredende halvledende film. (A) Kemisk struktur af DPP halvledende polymer, PDMS, og PDCA-del introduceret i begge polymerskeletter
Strækbar, selvhelbredende og halvledende polymerfilm til elektronisk hud (e-skin)Design og karakterisering af belastningsfølsomme, strækbar, og selvhelbredende halvledende film. (A) Kemisk struktur af DPP halvledende polymer, PDMS, og PDCA-del introduceret i begge polymerskeletter
- Hubble kigger nærmere på en knap så død nabo
- Hvordan dinosaurs blodkar bevares gennem tiderne
- Fermentering sker i fravær af ilt, så hvad kaldes det?
- Hvordan en 'skyggezone' fanger verdens ældste havvand
- Hvilket objekt udøver den største tyngdekraft inden for vores solsystem?
- Billeverandør bringer elektriske leveringsrobotter til Detroit


