Hvorfor reagerer klor let?
1. Elektronegativitet: Klor er meget elektronegativ, hvilket betyder, at det har en stærk attraktion for elektroner. Dette gør det ivrig efter at få et elektron for at opnå en stabil oktetkonfiguration.
2. Lille atomradius: Klor har en relativt lille atomradius, hvilket betyder, at dens kerne kan udøve et stærkere træk på elektroner. Dette gør det lettere for klor at tiltrække elektroner og danne bindinger.
3. Høj elektronaffinitet: Klor har en høj elektronaffinitet, hvilket betyder, at det frigiver en betydelig mængde energi, når den får en elektron. Denne frigivelse af energi gør reaktionen mere gunstig.
4. Reaktivitet af ikke-metaler: Som ikke-metal har klor en tendens til at reagere med andre ikke-metaller og metaller til dannelse af forbindelser. Dette skyldes, at det søger at få elektroner for at opnå en stabil elektronkonfiguration.
5. Eksistens som et diatomisk molekyle: Klor findes som et diatomisk molekyle (CL2), hvilket betyder, at to kloratomer er bundet sammen. Denne binding er relativt svag, hvilket gør det muligt for molekylet let at bryde fra hinanden og reagere med andre stoffer.
6. Oxidationsegenskaber: Klor er et stærkt oxidationsmiddel. Det får let elektroner fra andre stoffer, oxideres dem og får sig til at blive reduceret.
I resumé bidrager klorens høje elektronegativitet, lille størrelse, høj elektronaffinitet, ikke-metallisk karakter, diatomisk struktur og oxidationsegenskaber alle til dens høje reaktivitet.
Det er vigtigt at bemærke, at selvom klor reagerer let, er det også et meget nyttigt element. Det bruges i forskellige anvendelser, herunder vandrensning, blegemiddelproduktion og produktion af plast og lægemidler. Imidlertid gør dens høje reaktivitet også det potentielt farligt, og den skal håndteres med omhu.
Sidste artikelHvilken forekomst er en vigtig kilde til gasser, der kan producere sur regn?
Næste artikelHvilke elementer ligner mest svovl?
 Varme artikler
Varme artikler
-
 Langtidsvarmelagrende keramik absorberer termisk energi fra varmt vandFørste-princippets beregninger af dannelsesenergier. (A) Periodisk system farvet af de samlede elektroniske energier af λ-Ti3O5 med en elementær substitution. Blå grundstoffer er dem, hvor substituere
Langtidsvarmelagrende keramik absorberer termisk energi fra varmt vandFørste-princippets beregninger af dannelsesenergier. (A) Periodisk system farvet af de samlede elektroniske energier af λ-Ti3O5 med en elementær substitution. Blå grundstoffer er dem, hvor substituere -
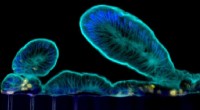 Typisk:Fra menneskelig biopsi til kompleks tarmfysiologi på en chipVilli-lignende forlængelser, som primære tyndtarmsceller stikker ud i lumen i chipens epitelkanal. Kredit:Wyss Institute ved Harvard University Tyndtarmen er det vigtigste sted, hvor vi fordøjer o
Typisk:Fra menneskelig biopsi til kompleks tarmfysiologi på en chipVilli-lignende forlængelser, som primære tyndtarmsceller stikker ud i lumen i chipens epitelkanal. Kredit:Wyss Institute ved Harvard University Tyndtarmen er det vigtigste sted, hvor vi fordøjer o -
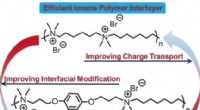 Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku
Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku -
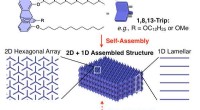 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
- Baggrundsswap-teknologi egnet til mobiltelefoner annonceret
- Hvad er navnene på 5 caribiske forskere, og hvad opdagede de?
- Rock Lessons med aktiviteter til den første Grade
- Skønheden ved krabbeblodparasitter:Vinder af 2018 Research as Art-priser annonceret
- Hvad er karakteristikken ved Dwarf Planet?
- Hvad forårsager konvektionsstrømme på mantlen?


