Hvad sker der med kogepunkterne på kulbrinter, når de bliver større?
* van der Waals Forces: Større kulbrinter har flere elektroner, hvilket fører til stærkere London -spredningskræfter (en type van der Waals Force). Disse kræfter stammer fra midlertidige udsving i elektronfordeling, hvilket skaber midlertidige dipoler, der tiltrækker hinanden.
* overfladeareal: Større kulbrinter har et større overfladeareal for disse intermolekylære kræfter at handle på.
* mere energi krævet: For at bryde disse stærkere intermolekylære kræfter er der behov for mere energi (i form af varme) for at overvinde dem og nå kogepunktet.
Kortfattet: Når carbonhydridmolekyler stiger i størrelse, kræver de stærkere van der Waals kræfter mere energi for at overvinde, hvilket resulterer i højere kogepunkter.
 Varme artikler
Varme artikler
-
 Hærens nye fund sænker utilsigtet detonation af lagreLaser-induceret plasma:Snapshots fra højhastighedsvideo, der viser dannelsen af et laser-induceret plasma (8,9 mm højt) på en eksplosiv rest; den resulterende chokbølge vises i det første billede. K
Hærens nye fund sænker utilsigtet detonation af lagreLaser-induceret plasma:Snapshots fra højhastighedsvideo, der viser dannelsen af et laser-induceret plasma (8,9 mm højt) på en eksplosiv rest; den resulterende chokbølge vises i det første billede. K -
 Forskere vækker DNA fra jordbakterier for at opdage nyt syreantibiotikumAntibiotikadråber produceret af Streptomyces coelicolor dyrket på en petriskål. Kredit:University of Warwick Sklerinsyre er blevet opdaget ved at fange og konstruere et DNA-fragment fra jordbakt
Forskere vækker DNA fra jordbakterier for at opdage nyt syreantibiotikumAntibiotikadråber produceret af Streptomyces coelicolor dyrket på en petriskål. Kredit:University of Warwick Sklerinsyre er blevet opdaget ved at fange og konstruere et DNA-fragment fra jordbakt -
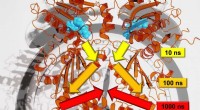 Forskere undersøger signaloverførsel i proteiner på tværs af flere tidsskalaerForskere fra Freiburg har været i stand til at analysere den præcise signaloverførselshastighed på tværs af flere tidsskalaer. Kredit:Steffen Wolf Overvej et øjeblik et træ, der svajer i vinden. H
Forskere undersøger signaloverførsel i proteiner på tværs af flere tidsskalaerForskere fra Freiburg har været i stand til at analysere den præcise signaloverførselshastighed på tværs af flere tidsskalaer. Kredit:Steffen Wolf Overvej et øjeblik et træ, der svajer i vinden. H -
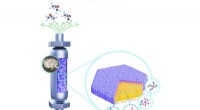 Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de
Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de
- Hvad er den kemiske formel for natriumthiosulfat og vand?
- Hvad er det næste for Artemis I efter 2. scrub?
- Hvad er det videnskabelige navn eller taksonomiske klassificering af plantens årlige Ragweed?
- Globe Talk:Robotter svar på immigration?
- Mexicos dyrebare strande truet af ildelugtende algeinvasion
- Hvordan kan du træne honningbier til at snuse efter bomber?


