Er de fleste hydroxidforbindelser opløselige i vand?
Her er hvorfor:
* gruppe 1 hydroxider (Lioh, NaOH, KOH, RBOH, CSOH): Disse er meget opløselige på grund af de stærke ioniske bindinger mellem alkalimetaller og hydroxidion.
* gruppe 2 hydroxider (CA (OH) 2, SR (OH) 2, BA (OH) 2): Disse er moderat opløselige, hvor opløseligheden øges ned i gruppen.
* Andre hydroxider: Størstedelen af hydroxider dannet med overgangsmetaller og ikke-metaller er uopløselige i vand. Dette skyldes, at bindingen mellem metalkationen og hydroxidanionen ofte er stærkere end tiltrækningen mellem ioner og vandmolekyler.
Undtagelser:
* ammoniumhydroxid (NH4OH): Mens det er teknisk en svag base, er den meget opløselig i vand, der let danner ammoniumioner (NH4+) og hydroxidioner (OH-).
Key Takeaway: Mens nogle hydroxider er meget opløselige, er mange ikke. Generelt bliver hydroxider mere opløselige, når du bevæger dig ned ad den periodiske tabel i grupper 1 og 2.
Sidste artikelHvad er et postulat af den kinetiske molekylære teori?
Næste artikelHvad er atomnummer?
 Varme artikler
Varme artikler
-
 Ny katalytisk proces gør plastposer til limBrug af en katalysator baseret på ruthenium (guldkugle, centrum), UC Berkeley -kemikere var i stand til at tilføje specifikke kemiske grupper - i dette tilfælde, OH (rød) - til polyethylenpolymerkæder
Ny katalytisk proces gør plastposer til limBrug af en katalysator baseret på ruthenium (guldkugle, centrum), UC Berkeley -kemikere var i stand til at tilføje specifikke kemiske grupper - i dette tilfælde, OH (rød) - til polyethylenpolymerkæder -
 Forskere producerer en biocelle lige så effektiv som en platinbrændselscelleBiocelle, der bruger H2/O2-brændstof baseret på en varmestabil hydrogenase, der modstår ilt og et kulilte ved anoden og en varmestabil bilirubinoxidase ved katoden, der giver strømme i størrelsesorden
Forskere producerer en biocelle lige så effektiv som en platinbrændselscelleBiocelle, der bruger H2/O2-brændstof baseret på en varmestabil hydrogenase, der modstår ilt og et kulilte ved anoden og en varmestabil bilirubinoxidase ved katoden, der giver strømme i størrelsesorden -
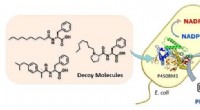 Tricker bakterier til hydroxylerende benzenFig.1 Phenolproduktion ved hjælp af bakterier. Kredit:Osami Shoji og Masayuki Karasawa Forskere ved Nagoya University bruger E.coli til at omdanne benzen til phenol, forenkling af en kemisk reakti
Tricker bakterier til hydroxylerende benzenFig.1 Phenolproduktion ved hjælp af bakterier. Kredit:Osami Shoji og Masayuki Karasawa Forskere ved Nagoya University bruger E.coli til at omdanne benzen til phenol, forenkling af en kemisk reakti -
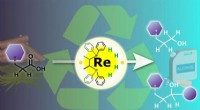 Kemikere sætter metalkatalyse på hovedet for en bæredygtig fremtidEn rheniumkatalysator i høj oxidationstilstand bruges til at hydrogenere carboxylsyrer, der findes i organisk affald, producere en række nyttige alkoholprodukter. Kredit:Nagoya University Nagoya U
Kemikere sætter metalkatalyse på hovedet for en bæredygtig fremtidEn rheniumkatalysator i høj oxidationstilstand bruges til at hydrogenere carboxylsyrer, der findes i organisk affald, producere en række nyttige alkoholprodukter. Kredit:Nagoya University Nagoya U
- Hvordan talegenkendelsesteknikker hjælper med at forudsige vulkaners adfærd
- Hvilket videnskabsområde kommer geologi under?
- Hvad er eksempler på termisk ekspansion en væske?
- Sådan glemmer planter:Nyt arbejde afslører, hvordan epigenetiske mærker specifikt nulstilles i sæ…
- Hvad er et ikke-eksempel på fortyndet opløsning?
- Sådan finder du overfladearealet af en trekantet prism


