Hvorfor forekommer hydrogenbindinger i vand?
1. vandstruktur: Et vandmolekyle (H₂O) består af to hydrogenatomer bundet til et iltatom.
2. Oxygen's elektronegativitet: Oxygen er meget elektronegativ, hvilket betyder, at det tiltrækker elektroner stærkere end brint. Dette skaber en polær kovalent binding inden for vandmolekylet. Oxygenatomet får en delvis negativ ladning (Δ-), mens brintatomerne får delvis positive ladninger (δ+).
3. Hydrogenbinding: Det delvist positive hydrogenatom i et vandmolekyle tiltrækkes af det delvist negative iltatom i et andet vandmolekyle. Denne elektrostatiske attraktion kaldes en brintbinding.
4. Betydning: Hydrogenbindinger er relativt svage sammenlignet med kovalente bindinger, men de er kollektivt stærke nok til at påvirke mange af vandets unikke egenskaber:
* Højt kogepunkt: Vand har et overraskende højt kogepunkt for sin molekylvægt på grund af den energi, der kræves for at bryde brintbindingerne mellem vandmolekyler.
* højt smeltepunkt: I lighed med kogepunktet bidrager de stærke hydrogenbindinger mellem vandmolekyler til dets relativt høje smeltepunkt.
* Høj overfladespænding: Vandmolekyler ved overfladen danner stærke brintbindinger med hinanden, hvilket resulterer i høj overfladespænding.
* universelt opløsningsmiddel: Polariteten af vand og dets evne til at danne brintbindinger gør det til et fremragende opløsningsmiddel for mange stoffer, inklusive salte og sukker.
Sammenfattende tillader kombinationen af vandstruktur, ilts elektronegativitet og de resulterende delvise ladninger vandmolekyler at danne brintbindinger, der bidrager til dets unikke egenskaber og gør det essentielt for livet på jorden.
Sidste artikelHvordan fremstiller du 50 mm ammoniumacetatopløsning?
Næste artikelHvad sker der, når natriumcarbonat og eddike tilsættes?
 Varme artikler
Varme artikler
-
 Nye syntetiske proteiner konkurrerer med deres naturlige modstykker inden for protontransportForskere skabte en ny polymer, der er lige så effektiv som naturlige proteiner til at transportere protoner gennem en membran. Kredit:ORNL/Jill Hemman Biologiske membraner, såsom vægge i de fleste
Nye syntetiske proteiner konkurrerer med deres naturlige modstykker inden for protontransportForskere skabte en ny polymer, der er lige så effektiv som naturlige proteiner til at transportere protoner gennem en membran. Kredit:ORNL/Jill Hemman Biologiske membraner, såsom vægge i de fleste -
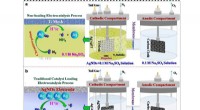 Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at -
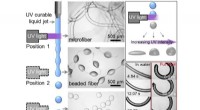 Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti
Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti -
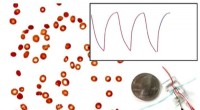 Forskere udvikler ny metode til hurtigt, pålideligt overvåge seglcellesygdomSeglcellesygdom er en arvelig lidelse, der påvirker røde blodlegemer, forvrængning af deres naturlige skiveform til en halvmåne- eller segl-form. Normale røde blodlegemer bevæger sig frit gennem små k
Forskere udvikler ny metode til hurtigt, pålideligt overvåge seglcellesygdomSeglcellesygdom er en arvelig lidelse, der påvirker røde blodlegemer, forvrængning af deres naturlige skiveform til en halvmåne- eller segl-form. Normale røde blodlegemer bevæger sig frit gennem små k
- Forskel mellem en regulator og en konformator
- Hvad betragtes som en sovende organisme?
- Hvilken kraft eksisterer mellem objekter i fravær af direkte fysisk kontakt?
- Hvilken faktor ville have den største effekt på strømmen af energi ind i et økosystem?
- Hvilket metal har den specifikke varme på 0,30?
- Hvorfor sker jordskælv for det meste langs tektoniske pladergrænser?


