Hvorfor Valency of Sulphur er 2 4 og 6?
Her er hvorfor:
* Valency Henviser til antallet af elektroner, som et atom kan få, tabe eller dele for at danne kemiske bindinger. Det er en fast værdi bestemt af antallet af elektroner i den yderste skal af et atom.
* Oxidationstilstand på den anden side er et mål for den tilsyneladende ladning af et atom i en forbindelse. Det kan være positivt, negativt eller nul.
Svovls elektronkonfiguration
Svovl har 6 valenselektroner (elektroner i sin yderste skal). Dette betyder, at det potentielt kan få 2 elektroner til at afslutte sin oktet, hvilket fører til en -2 -ladning. Imidlertid kan svovl også dele sine elektroner på forskellige måder:
* +2 Oxidationstilstand: Svovl kan dele to elektroner, hvilket resulterer i en +2 oxidationstilstand. For eksempel deler svovl i hydrogensulfid (H₂S) to elektroner med to hydrogenatomer.
* +4 oxidationstilstand: Svovl kan dele fire elektroner, hvilket resulterer i en +4 oxidationstilstand. Dette ses i svovldioxid (SO₂).
* +6 oxidationstilstand: Svovl kan dele alle seks af sine valenselektroner og opnå en +6 oxidationstilstand. Dette findes i svovlsyre (H₂so₄).
Betydningen af oxidationstilstande
At forstå oxidationstilstande er afgørende i kemi, fordi det hjælper os:
* forudsige elementernes kemiske opførsel: Forskellige oxidationstilstande fører til forskellige kemiske egenskaber.
* Navn og klassificering af forbindelser: At kende et elements oxidationstilstand hjælper os med at forstå dens rolle i en forbindelse.
* Balance kemiske ligninger: Oxidationstilstande bruges til at spore overførslen af elektroner i reaktioner.
Kortfattet: Mens svovl ikke har en fast valens på 2, 4 og 6, kan den udvise en række oxidationstilstande på grund af dens evne til at dele sine valenselektroner på forskellige måder. Denne alsidighed gør svovl til en nøglekomponent i mange vigtige kemiske forbindelser.
Sidste artikelHvor mange atomer af svovl er der i 2 mol svovl?
Næste artikelHvorfor bruges sølvnitrat og ethanol i Haloalkane -hydrolyse?
 Varme artikler
Varme artikler
-
 Pharma sigter mod at lave en bedre CBDKredit:CC0 Public Domain Cannabidiol (CBD) er en stadig mere populær wellness-trend. Sammensætningen, som forekommer naturligt i cannabisplanter, er tilføjet til mange produkter, der hævder at red
Pharma sigter mod at lave en bedre CBDKredit:CC0 Public Domain Cannabidiol (CBD) er en stadig mere populær wellness-trend. Sammensætningen, som forekommer naturligt i cannabisplanter, er tilføjet til mange produkter, der hævder at red -
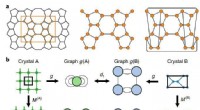 En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind -
 Overfladekemi afslører ætsende hemmelighederPoleret jern, der udsættes for elektrolytopløsninger, nedbrydes og danner jerncarbonat- og calciumcarbonatfilm, når det udsættes for ilt og en heterogen blanding af blodplader. Kredit:Mikhail Trought,
Overfladekemi afslører ætsende hemmelighederPoleret jern, der udsættes for elektrolytopløsninger, nedbrydes og danner jerncarbonat- og calciumcarbonatfilm, når det udsættes for ilt og en heterogen blanding af blodplader. Kredit:Mikhail Trought, -
 Første nogensinde atomopløsningsvideo af saltkrystaller, der dannes i realtidEn natriumchlorid krystal, der vokser i et vibrerende kulstof nanohorn. Kredit:© 2021 American Chemical Society To nye teknikker, atomopløsning i realtid video og konisk carbon nanorør indeslutnin
Første nogensinde atomopløsningsvideo af saltkrystaller, der dannes i realtidEn natriumchlorid krystal, der vokser i et vibrerende kulstof nanohorn. Kredit:© 2021 American Chemical Society To nye teknikker, atomopløsning i realtid video og konisk carbon nanorør indeslutnin
- Hydrologiske simuleringsmodeller, der informerer om politiske beslutninger, er vanskelige at fortolk…
- Er der skjoldvulkaner i ringen af ild?
- Ultraviolet lys fra superluminous supernova nøgle til afslørende eksplosionsmekanisme
- Hvorfor ikke bare bruge den energi, der forbruges at køre varmepumpen til at køre elektriske varme…
- Klipper inden for jorden bevæger sig og skifter over tid på grund af hvad?
- Hvad er den logiske og systematiske måde at besvare videnskabsspørgsmål på?


