Hvad ville et chloratom have en tendens til at binde med en anden form en ionisk forbindelse, og hvorfor?
* Elektronkonfiguration: Chlor har 7 elektroner i sin yderste skal (Valence Shell). Det har brug for endnu en elektron for at opnå en stabil octet -konfiguration som den ædle gas -argon.
* Elektro negativitet: Klor er meget elektronegativ, hvilket betyder, at det har en stærk attraktion for elektroner.
* ionisk binding: Ionisk binding forekommer mellem et metal (som har en tendens til at miste elektroner) og en ikke -metal (som har en tendens til at vinde elektroner). Chlor, der er en ikke -metal, accepterer let et elektron for at blive en negativt ladet ion (anion).
Eksempel: I dannelsen af natriumchlorid (NaCl) mister natrium (Na) en elektron for at blive en positivt ladet ion (kation), mens klor får den elektron til at blive en negativt ladet ion (anion). De modsatte ladninger tiltrækker derefter hinanden og danner den ioniske forbindelse.
Kortfattet: Chlorens ønske om at opnå en stabil elektronkonfiguration og dens høje elektronegativitet gør det meget sandsynligt, at det får en elektron og danner en anion, hvilket fører til dannelse af ioniske forbindelser.
Sidste artikelHvad er den kemiske formel for jernjod?
Næste artikelHvilken forbindelse er Fe CO3 3?
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab
Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab -
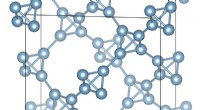 Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult
Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult -
 Fluorescerende sonde kunne lyse op kræftVed at belyse enzymet beta-galactosidase i en cellekultur, Michigan Tech kemikere håber at gøre det lettere at efterlade mere sundt væv i kræftkirurgi. En fluorescerende sonde udviklet af Michigan
Fluorescerende sonde kunne lyse op kræftVed at belyse enzymet beta-galactosidase i en cellekultur, Michigan Tech kemikere håber at gøre det lettere at efterlade mere sundt væv i kræftkirurgi. En fluorescerende sonde udviklet af Michigan -
 Syntese af nye røde fosfor med et smart materiale som værtsmaterialeLTT-phosphor (venstre), LNT-phosphor (højre). Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology brugte et materiale med en unik periodisk str
Syntese af nye røde fosfor med et smart materiale som værtsmaterialeLTT-phosphor (venstre), LNT-phosphor (højre). Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology brugte et materiale med en unik periodisk str
- Hvad bruger forskere til at beregne, hvor hurtigt pladerne bevæger sig?
- Hvor mange gange har du rejst rundt om solen?
- Hvad er massen i gram af en mol svovldioxid SO2?
- Molekylære fabrikker:Kombinationen mellem natur og kemi er funktionel
- Lederens effektivitet kan afhænge af følelsesmæssige udtryk
- Hvilke organismer kræver ikke, at sollys lever, hvad hedder de?


