Hvorfor ser ændringen for atomradier af elementer i periode 3 fra natrium til argon lignende 2?
Ligheder:
* faldende atomradius: Begge perioder viser et fald i atomradius, når du bevæger dig fra venstre mod højre. Dette skyldes den stigende nukleare ladning (antal protoner). Den større tiltrækning mellem kernen og elektronerne trækker elektronerne nærmere og krymper atomet.
* Elektroner tilføjet til samme energiniveau: I begge perioder føjes elektronerne til det samme vigtigste energiniveau (n =2 i periode 2, n =3 i periode 3). Dette betyder, at elektronerne generelt er i samme afstand fra kernen, hvilket bidrager til den samlede størrelse tendens.
Forskelle:
* afskærmningseffekt: I periode 3 giver det øgede antal indre skalelektroner (elektroner i n =1 og n =2 niveauer) mere afskærmning fra kernen for valenselektroner (elektroner i n =3 -niveauet). Denne afskærmning reducerer den effektive atomafgift, der føles af valenselektronerne, hvilket forårsager en lidt større atomradius i periode 3 end i periode 2 for tilsvarende elementer.
* Elektronafvisning: I periode 3 fører det øgede antal elektroner i det samme energiniveau til større elektronelektron-frastødelse. Denne frastødelse skubber elektronerne længere fra hinanden, hvilket gør atomet lidt større.
Sammendrag:
Mens tendensen med faldende atomradius på tværs af perioder 2 og 3 er ens, resulterer den øgede afskærmning og elektronafvisning i periode 3 lidt større atomradier sammenlignet med de tilsvarende elementer i periode 2.
Key Takeaway: De periodiske tendenser i atomradier er drevet af et komplekst samspil af faktorer, herunder atomafgift, afskærmningseffekt og elektronelektron-frastødelse. Disse faktorer påvirker størrelsen på atomet og skaber forskellige tendenser på tværs af perioder og nedgrupper.
Sidste artikelHvad hedder Compound med Formel PBCO3?
Næste artikelHvad er oxidationstilstanden S i SO42-?
 Varme artikler
Varme artikler
-
 Et nyt tekstilmateriale, der holder sig bakteriefritNærbillede af en Surfaceskins-enhed, der viser de små ventiler, der pumper alkoholgel på overfladen. Kredit:Surfaceskins Forskere har udviklet et nyt våben i kampen mod dødelige hospitalserhverved
Et nyt tekstilmateriale, der holder sig bakteriefritNærbillede af en Surfaceskins-enhed, der viser de små ventiler, der pumper alkoholgel på overfladen. Kredit:Surfaceskins Forskere har udviklet et nyt våben i kampen mod dødelige hospitalserhverved -
 Ingeniører er pionerer i platinskaldannelsesprocessen, opnå første observation nogensindeEn skal af platin vokser lag for lag under iltudglødning. Kredit:Pan Group / UCI UCI-forskere har udtænkt en ny metode til dynamisk at danne en platinskal på en nanopartikelkerne af metallisk lege
Ingeniører er pionerer i platinskaldannelsesprocessen, opnå første observation nogensindeEn skal af platin vokser lag for lag under iltudglødning. Kredit:Pan Group / UCI UCI-forskere har udtænkt en ny metode til dynamisk at danne en platinskal på en nanopartikelkerne af metallisk lege -
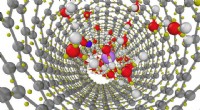 Indkredsning af virkningerne af nanoindeslutning på vandStruktur af en lithiumchloridopløsning indespærret i et 1,1 nanometer diameter carbon nanorør som opnået fra første principper molekylær dynamik simuleringer. Billede af Viktor Rozsa/University of Chi
Indkredsning af virkningerne af nanoindeslutning på vandStruktur af en lithiumchloridopløsning indespærret i et 1,1 nanometer diameter carbon nanorør som opnået fra første principper molekylær dynamik simuleringer. Billede af Viktor Rozsa/University of Chi -
 Metalskum stopper .50 kaliberrunder samt stål - med mindre end halvdelen af vægtenForskere har demonstreret, at køretøjs rustninger ved hjælp af kompositmetalskum (CMF) kan stoppe kugle- og rustningspiercing .50 kaliberrunder samt konventionelle stål rustninger, selvom den vejer mi
Metalskum stopper .50 kaliberrunder samt stål - med mindre end halvdelen af vægtenForskere har demonstreret, at køretøjs rustninger ved hjælp af kompositmetalskum (CMF) kan stoppe kugle- og rustningspiercing .50 kaliberrunder samt konventionelle stål rustninger, selvom den vejer mi
- Olympic Math Aktiviteter for Elementary
- Jordskælv er muligvis ikke den primære årsag til oversvømmelser af gletsjersøudbrud
- Synkrotronstråling kaster lys over dannelsesmekanismen for aromatisk polyimid-precursor
- Forskerteam udvikler ny ultralydsdrevet aktuator til udvikling af mikrorobot
- Hvad er vigtigheden af meiose i arvelighed og naturlig selektion?
- Hvad er de almindelige anvendelser af titanium?


