Betyder en pH -værdi et vist antal brint- eller hydroxidioner?
Her er hvorfor:
* ph =-log [H+] hvor [H+] er hydrogenionkoncentrationen i mol pr. Liter (M).
* skalaen er logaritmisk , hvilket betyder, at hvert hele antal ændringer i pH repræsenterer en ti gange ændring i hydrogenionkoncentration.
* En lavere pH indikerer en højere koncentration af brintioner , hvilket gør opløsningen mere sur.
* En højere pH indikerer en lavere koncentration af brintioner , hvilket gør løsningen mere grundlæggende (alkalisk).
mens pH ikke direkte giver det nøjagtige antal ioner , ved at kende pH giver dig mulighed for at beregne hydrogenionkoncentrationen:
* [H+] =10^-ph
Eksempel:
* En opløsning med en pH på 3 har en hydrogenionkoncentration på 10^-3 m (eller 0,001 m).
* En opløsning med en pH på 10 har en hydrogenionkoncentration på 10^-10 M.
Vigtig note:
* Forholdet mellem pH og hydroxidioner er omvendt . En højere pH indikerer en lavere koncentration af hydroxidioner og vice versa.
* Produktet af hydrogenionkoncentration og hydroxidionkoncentration er konstant (KW =10^-14 ved 25 ° C).
Derfor ved at kende pH i en opløsning giver du dig mulighed for at bestemme den relative koncentration af hydrogenioner og hydroxidioner, men det giver ikke det nøjagtige antal ioner til stede.
Sidste artikelHvad mener du med 100 volumen hydrogenperoxid?
Næste artikelHvad viser formlen NA2CO3 om forbindelse?
 Varme artikler
Varme artikler
-
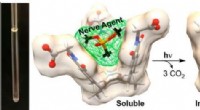 Indfangning af giftige forbindelser med molekylære kurveKredit:Ohio State University Forskere har udviklet designermolekyler, som måske en dag kan opsøge og fange dødelige nervestoffer og andre giftige forbindelser i miljøet – og muligvis i mennesker.
Indfangning af giftige forbindelser med molekylære kurveKredit:Ohio State University Forskere har udviklet designermolekyler, som måske en dag kan opsøge og fange dødelige nervestoffer og andre giftige forbindelser i miljøet – og muligvis i mennesker. -
 Nanocoating gør letvægtsmetalskum benhårdt og eksplosionssikkertHenter inspiration fra knogler:Materialeforskerne Stefan Diebels (l.) og Anne Jung kan tilpasse deres lette og stærke metalskum til en bred vifte af anvendelser. Kredit:Oliver Dietze Metallisk sku
Nanocoating gør letvægtsmetalskum benhårdt og eksplosionssikkertHenter inspiration fra knogler:Materialeforskerne Stefan Diebels (l.) og Anne Jung kan tilpasse deres lette og stærke metalskum til en bred vifte af anvendelser. Kredit:Oliver Dietze Metallisk sku -
 Flamme på! Hvordan AI kan tæmme en kompleks materialeteknik og transformere fremstillingJoseph Libera og Anthony Stark forbereder sig til in-situ Raman-spektroskopi. Kredit:Argonne National Laboratory Oprettelse af nanomaterialer med flammespraypyrolyse er kompleks, men forskere ved
Flamme på! Hvordan AI kan tæmme en kompleks materialeteknik og transformere fremstillingJoseph Libera og Anthony Stark forbereder sig til in-situ Raman-spektroskopi. Kredit:Argonne National Laboratory Oprettelse af nanomaterialer med flammespraypyrolyse er kompleks, men forskere ved -
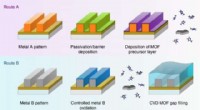 Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
- Hvilken enhed omdanner elektrisk energi til en mekanisk energi?
- Hvilken type ioner danner grundstofferne gruppe 1?
- Globale sundhedsfordele ved klimaindsats opvejer omkostningerne
- Er ammoniumsulfat fast eller væske?
- Hvilken elementær partikel er ansvarlig for kemiske egenskaber?
- Forskere får fotoner til at interagere, tage et skridt i retning af langlevende kvantehukommelse


