Hvad er forskellen mellem natriumion og neonatom?
1. Antal elektroner:
* natriumion (Na+): Har 10 elektroner. Det mister en elektron fra sin neutrale tilstand (11 elektroner) for at opnå en stabil oktet i sin yderste skal.
* neonatom (NE): Har 10 elektroner. Den har allerede en fuld oktet i sin yderste skal, hvilket gør den meget stabil.
2. Gebyr:
* natriumion (Na+): Har en positiv ladning (+1) på grund af tabet af en elektron.
* neonatom (NE): Har ingen gebyr (neutral). Det har et lige antal protoner og elektroner.
3. Reaktivitet:
* natriumion (Na+): Meget reaktiv i sin neutrale tilstand (natriummetal), men relativt ureaktiv som en ion på grund af dens stabile elektronkonfiguration.
* neonatom (NE): Ekstremt ureaktiv på grund af sin fulde ydre skal af elektroner. Det er en ædel gas.
4. Kemisk binding:
* natriumion (Na+): Formularer ioniske bindinger med negativt ladede ioner (anioner) for at opnå stabilitet.
* neonatom (NE): Danner ikke let kemiske bindinger, da det allerede er stabilt.
Kortfattet:
Natrium og neon, mens de er ved siden af det periodiske tabel, har drastisk forskellige egenskaber på grund af deres elektronkonfigurationer. Natriums ønske om at opnå en stabil octet driver sin reaktivitet, mens Neons allerede stabile oktet gør det inert.
Sidste artikelHvad er pH for ALCL3 og H20?
Næste artikelHvad fortæller formlen NH3 dig om hvert molekyle af ammoniak?
 Varme artikler
Varme artikler
-
 Biologisk inspireret, højtydende polyurethan udviklet til strækbar elektronikKredit:CC0 Public Domain En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) udviklede en polyu
Biologisk inspireret, højtydende polyurethan udviklet til strækbar elektronikKredit:CC0 Public Domain En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) udviklede en polyu -
 Optagelse af 3-D mikrostrukturer i realtidMaskinlæring aktiveret karakterisering af 3D-mikrostruktur, der viser korn af forskellige størrelser og deres grænser. Kredit:Argonne National Laboratory Moderne videnskabelig forskning i material
Optagelse af 3-D mikrostrukturer i realtidMaskinlæring aktiveret karakterisering af 3D-mikrostruktur, der viser korn af forskellige størrelser og deres grænser. Kredit:Argonne National Laboratory Moderne videnskabelig forskning i material -
 Ioniske edderkoppespind, der imiterer dobbelte funktioner i ægte edderkoppespindKredit:Unsplash/CC0 Public Domain Et team af forskere fra Seoul National University og Eumam Middle School har udviklet en type ionisk edderkoppespind, der er i stand til at efterligne dobbelte fu
Ioniske edderkoppespind, der imiterer dobbelte funktioner i ægte edderkoppespindKredit:Unsplash/CC0 Public Domain Et team af forskere fra Seoul National University og Eumam Middle School har udviklet en type ionisk edderkoppespind, der er i stand til at efterligne dobbelte fu -
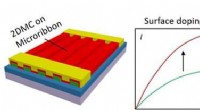 2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt
2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt
- Partikler, der kan klassificeres af deres egenskaber, udgør hvad?
- Hvordan kan halvledermateriale laves til at blive enten en dirigent eller en isolator?
- Hvad er hovedretningen af spænding på blokke rock ved normale forkastninger reverse og strike-sl…
- Hvilken type bevægelse udstilles af en kugle kastet op uniform eller ikke hvorfor?
- Er en opadgående kraft, der enten baiancer eller overstiger tyngdekraften?
- Her er grunden til, at konservative og liberale adskiller sig om COVID-19


