Hvorfor fast natriumchlorid ikke udfører elektricitet?
* ionisk struktur: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det er sammensat af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse ioner holdes sammen af stærke elektrostatiske kræfter i et regelmæssigt, gentagne mønster kaldet en krystalgitter.
* faste ioner: I fast tilstand er ionerne tæt pakket og låst i deres positioner inden for gitteret. De kan kun vibrere lidt omkring deres faste positioner.
* Ingen gratis opladningsbærere: For et materiale, der skal ledes elektricitet, har det brug for frit bevægende ladede partikler (ladningsbærere), der kan bære en elektrisk strøm. I fast NaCl er ionerne ikke frie til at bevæge sig.
* Ledning i løsning: Men når NaCl opløses i vand, bliver ionerne hydreret (omgivet af vandmolekyler) og adskilt fra gitteret , så de kan bevæge sig frit. Dette betyder, at løsningen nu kan udføre elektricitet.
* dirigering Når smeltet: Tilsvarende udfører smeltet NaCl (flydende tilstand) også elektricitet, fordi ionerne ikke længere holdes i en stiv struktur og kan bevæge sig frit.
Kortfattet: Fast natriumchlorid udfører ikke elektricitet, fordi dets ioner er fikseret i et krystalgitter, hvilket forhindrer den frie bevægelse af ladning, der kræves til ledning.
Sidste artikelHvad er farven på kobberion?
Næste artikelHvad har flere ydre elektroner fosfor eller silicium?
 Varme artikler
Varme artikler
-
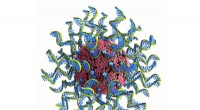 Ny maskinlæringsteknik analyserer hurtigt nanomedicin til kræftimmunterapiSNAer er kuglelignende former for DNA og RNA arrangeret på overfladen af en nanopartikel. Kredit:Chad Mirkin/Northwestern University Sfæriske nukleinsyrer er en klasse af personlig medicin til
Ny maskinlæringsteknik analyserer hurtigt nanomedicin til kræftimmunterapiSNAer er kuglelignende former for DNA og RNA arrangeret på overfladen af en nanopartikel. Kredit:Chad Mirkin/Northwestern University Sfæriske nukleinsyrer er en klasse af personlig medicin til -
 Fleksibel kvantesigte filtrerer brændstoffet fra rumskib EnterpriseKun deuterium kan åbne porerne i DUT-8, mens brint efterlader rammen lukket. Denne meget selektive detektion fører til en høj separationsselektivitet kombineret med høj deuteriumoptagelse. Kredit:Dr.
Fleksibel kvantesigte filtrerer brændstoffet fra rumskib EnterpriseKun deuterium kan åbne porerne i DUT-8, mens brint efterlader rammen lukket. Denne meget selektive detektion fører til en høj separationsselektivitet kombineret med høj deuteriumoptagelse. Kredit:Dr. -
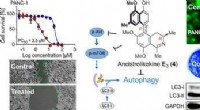 Rainforest vinforbindelse udsulter bugspytkirtelkræftcellerKredit:American Chemical Society Bugspytkirtelkræftceller er kendt for deres evne til at trives under ekstreme forhold med lave næringsstoffer og ilt, en egenskab kendt på kræftområdet som nøjsomh
Rainforest vinforbindelse udsulter bugspytkirtelkræftcellerKredit:American Chemical Society Bugspytkirtelkræftceller er kendt for deres evne til at trives under ekstreme forhold med lave næringsstoffer og ilt, en egenskab kendt på kræftområdet som nøjsomh -
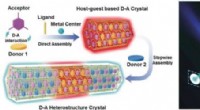 Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha
Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha
- Californien er hjemsted for millioner af bytræer:Hvad sker der, når de dør?
- Hvad er Nurtriture?
- Hvorfor er det nødvendigt at bruge specielle instrumenter måle temperaturen på atmosfæren i term…
- Solstormen giver et strålende lysshow over hele kloden, men der er ikke rapporteret om alvorlige pr…
- Hvor mange grader er vippaksen mellem december og juni?
- Hvorfor kan vi se planeter, selvom de ikke er en lyskilde?


