Hvad er molariteten af en opløsning, der indeholder 93,5 g kaliumchlorid opløst i 500 ml opløsning?
1. Bestem den molære masse af kaliumchlorid (KCL):
* Kalium (K) har en molmasse på 39,10 g/mol
* Chlor (CL) har en molmasse på 35,45 g/mol
* Molmasse KCL =39,10 g/mol + 35,45 g/mol =74,55 g/mol
2. Konverter massen af KCL til mol:
* Mol KCL =(Mass of Kcl) / (Molær masse af KCL)
* Mol KCL =93,5 g / 74,55 g / mol =1,25 mol
3. Konverter mængden af løsningen til liter:
* Volumen af opløsning =500 ml =0,5 l
4. Beregn molariteten (M):
* Molaritet (m) =(mol opløst stof) / (mængden af opløsning i liter)
* Molaritet (M) =1,25 mol / 0,5 L =2,5 m
Derfor er molariteten af kaliumchloridopløsningen 2,5 m.
 Varme artikler
Varme artikler
-
 Forskere konstruerer højstyrke mikrorør ved koaksial udskrivning med tilpasset biohybird hydrogel …Skematisk diagram af fremstilling og karakterisering af mikrorør. Kredit:SIAT Koaksial ekstruderingstryk har udviklet sig mod at generere mikrorør til efterligning af rørformede væv i disse år. Im
Forskere konstruerer højstyrke mikrorør ved koaksial udskrivning med tilpasset biohybird hydrogel …Skematisk diagram af fremstilling og karakterisering af mikrorør. Kredit:SIAT Koaksial ekstruderingstryk har udviklet sig mod at generere mikrorør til efterligning af rørformede væv i disse år. Im -
 Gennembrudssensor til at hjælpe mennesker med bipolar lidelse med at overvåge litiumniveauerKredit:University of Surrey Patienter, der lever med bipolar lidelse og depression, vil snart kunne bruge en unik bærbar sensor til sikkert at overvåge deres litiumniveau. I en undersøgelse udgiv
Gennembrudssensor til at hjælpe mennesker med bipolar lidelse med at overvåge litiumniveauerKredit:University of Surrey Patienter, der lever med bipolar lidelse og depression, vil snart kunne bruge en unik bærbar sensor til sikkert at overvåge deres litiumniveau. I en undersøgelse udgiv -
 En ny måde at modulere farveemissioner fra gennemsigtige filmEn ny undersøgelse fra Japan giver frisk indsigt i skabelsen af mere effektive flerfarvede transparente selvlysende materialer. Kredit:Tokyo University of Science Forskere ser på selvlysende gen
En ny måde at modulere farveemissioner fra gennemsigtige filmEn ny undersøgelse fra Japan giver frisk indsigt i skabelsen af mere effektive flerfarvede transparente selvlysende materialer. Kredit:Tokyo University of Science Forskere ser på selvlysende gen -
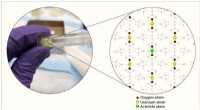 Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
Undersøgelse afslører et-trins strategi for genanvendelse af brugt nukleart brændselEt-trins kemisk reaktion foreskrevet i undersøgelsen fører til dannelsen af krystaller, der indeholder uran (gulfyldte cirkler) og små mængder af andre resterende brændstofelementer (grønfyldte cirk
- Er tang løsningen på bæredygtigt biobrændstof?
- Fremstilling af krystaller uden defekter til forskning
- Hvordan interagerer solstråling og infrarød med Jorden?
- Er celle opdaget ising elektronmikroskoper?
- Katalog over 208 menneskeskabte mineraler styrker argumentet for at erklære antropocæn epoke
- Sådan ser du levende maskiner


