Er CS3N formlen for en kovalent forbindelse?
Her er hvorfor:
* cesium (CS) er et metal, og metaller danner typisk ioniske bindinger med ikke -metaller.
* nitrogen (n) er en ikke -metal.
Mens forskellen i elektronegativitet mellem cæsium og nitrogen er meget stor, hvilket fører til en betydelig ionisk karakter, betragtes forbindelsen stadig som kovalent . Årsagen til dette er, at CS3N -strukturen involverer et komplekst netværk af kovalente obligationer snarere end den enkle elektrostatiske tiltrækningskarakteristik for ioniske forbindelser.
Selvom CS3N viser en vis ionisk karakter, betragtes den primært som en kovalent forbindelse på grund af arten af dens binding.
Sidste artikelHvor mange valenselektroner har ethanol?
Næste artikelHvad er elektrongeometrien af brom pentafluorid?
 Varme artikler
Varme artikler
-
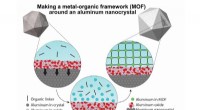 Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle
Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle -
 Sensorer på planteblade advarer om vandmangelKunstnerens indtryk af sensoren bestående af ledende blæk trykt på tværs af en stomi med to mikrosøjler. Kredit:Betsy Skrip Har du glemt at vande den plante på dit skrivebord igen? Det kan snart v
Sensorer på planteblade advarer om vandmangelKunstnerens indtryk af sensoren bestående af ledende blæk trykt på tværs af en stomi med to mikrosøjler. Kredit:Betsy Skrip Har du glemt at vande den plante på dit skrivebord igen? Det kan snart v -
 Teamarbejde i et molekyleDr. Helmar Görls studerer enkeltkrystaller af nye forbindelser ved hjælp af et røntgendiffraktometer ved Institut for Uorganisk og Analytisk Kemi ved Friedrich Schiller University i Jena, Tyskland. Kr
Teamarbejde i et molekyleDr. Helmar Görls studerer enkeltkrystaller af nye forbindelser ved hjælp af et røntgendiffraktometer ved Institut for Uorganisk og Analytisk Kemi ved Friedrich Schiller University i Jena, Tyskland. Kr -
 Ny katalysator opgraderer drivhusgas til vedvarende kulbrinterDr. Cao-Thang Dinh, venstre, og Dr. Md Golam Kibria demonstrerer deres nye katalysator. I et papir offentliggjort i dag i Science, deres team demonstrerede den mest effektive og stabile proces til at
Ny katalysator opgraderer drivhusgas til vedvarende kulbrinterDr. Cao-Thang Dinh, venstre, og Dr. Md Golam Kibria demonstrerer deres nye katalysator. I et papir offentliggjort i dag i Science, deres team demonstrerede den mest effektive og stabile proces til at
- Hvor mange kilowats er der i solen?
- Ny enhed styrer præcist fotonemission for mere effektive bærbare skærme
- Menneskelige påvirkninger på ferskvandsøkosystemer
- Hvorfor er en dampforbrænding værre end varmtvandsforbrænding?
- Ud over lyden:Rødøjede løvfrøer bruger lyd og vibrationer i opkald efter kammerater og aggressio…
- Hvilket kendetegn ved en civilisation giver normalt et sundt grundlag for fremskridt inden for kunst…


