Hvilken form forventer du for No2 - ion?
* Lewis -struktur: Det centrale nitrogenatom har tre elektrondomæner:en dobbeltbinding til et iltatom, en enkelt binding til et andet iltatom og et ensomt par.
* VSEPR -teori: VSEPR (Valence Shell Electron Pair Repulsion) teori forudsiger, at elektrondomæner omkring et centralt atom vil arrangere sig for at minimere frastødning. Tre elektrondomæner resulterer i en trigonal plan elektrongeometri.
* molekylær form: Det ensomme par på nitrogen udøver en stærkere frastødelse end bindingsparene og skubber de to iltatomer tættere sammen. Dette resulterer i en bøjet eller vinkelmolekylær form.
Kortfattet: No₂⁻ionen har en bøjet molekylær form på grund af tilstedeværelsen af et ensomt par på det centrale nitrogenatom.
Sidste artikelHvad er ligningen for hydrofluorinsyre og natriumhydroxid?
Næste artikelHvad er den kemiske tilstand af svovl?
 Varme artikler
Varme artikler
-
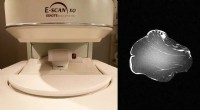 MR-teknik registrerer egenskaberne af emballeret kødKvaliteten af en lænd kan forudsiges ved at indsætte den i en MR-scanner og analysere dens magnetiske resonansbillede. Kredit:TECAL-GIM (UEx) Forskere fra University of Extremadura (Spanien) har
MR-teknik registrerer egenskaberne af emballeret kødKvaliteten af en lænd kan forudsiges ved at indsætte den i en MR-scanner og analysere dens magnetiske resonansbillede. Kredit:TECAL-GIM (UEx) Forskere fra University of Extremadura (Spanien) har -
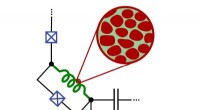 Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin -
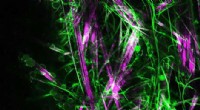 Et nyt geleringsmolekyle til voksende neuroner i 3DCeller indlejret i fibrene i N-heptyl-galactonamid-molekylgelen. Cellerne er runde og grønne. Lige, stive fibre er lyserøde. Buet, fleksible fibre er grønne. Kredit:Anaïs Chalard (IMRCP)-Laurence Vays
Et nyt geleringsmolekyle til voksende neuroner i 3DCeller indlejret i fibrene i N-heptyl-galactonamid-molekylgelen. Cellerne er runde og grønne. Lige, stive fibre er lyserøde. Buet, fleksible fibre er grønne. Kredit:Anaïs Chalard (IMRCP)-Laurence Vays -
 Forskere har fundet en måde at skabe lægemiddelmolekyler ud fra kulilteResultaterne af atomeffektivitetsreaktioner. Kredit:Denis Chusov Forskere fra RUDN Universitet har i samarbejde med russiske og udenlandske kolleger studeret reduktive amineringsreaktioner. De nye
Forskere har fundet en måde at skabe lægemiddelmolekyler ud fra kulilteResultaterne af atomeffektivitetsreaktioner. Kredit:Denis Chusov Forskere fra RUDN Universitet har i samarbejde med russiske og udenlandske kolleger studeret reduktive amineringsreaktioner. De nye


