Er vand en ionisk forbindelse, der kun kan opløses ioner?
* vand er en polær kovalent forbindelse: Vand (H₂O) dannes af kovalente bindinger mellem brint- og iltatomer. Elektronerne i disse bindinger deles ikke ens, hvilket resulterer i en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomet. Dette gør vand til et polært molekyle.
* Vand kan opløse både ioniske og polære kovalente forbindelser: Vands polaritet giver det mulighed for at interagere stærkt med både ioniske forbindelser og polære kovalente forbindelser:
* ioniske forbindelser: Vands delvise ladninger tiltrækker de modsatte ladede ioner i en krystalgitter, der bryder gitteret fra hinanden og opløser forbindelsen.
* polære kovalente forbindelser: Vand kan danne hydrogenbindinger med andre polære molekyler, hvilket fører til deres opløsning.
* vand kan også opløse nogle ikke -polære forbindelser i et begrænset omfang: Selvom vand primært er et godt opløsningsmiddel for polære og ioniske forbindelser, kan det også opløse nogle ikke -polære molekyler i lille grad. Dette skyldes van der Waals -kræfter mellem vandmolekyler og de ikke -polære molekyler.
Kortfattet: Vand er et kraftfuldt opløsningsmiddel på grund af dets polaritet, hvilket gør det muligt for det at opløse både ioniske og polære kovalente forbindelser effektivt. Mens dens primære rolle er at opløse disse typer forbindelser, kan den også opløse nogle ikke -polære forbindelser i mindre grad.
Sidste artikelHvad er faresymbolet for klorgas?
Næste artikelHvad bestemmer et atoms kemiske og elektriske egenskaber?
 Varme artikler
Varme artikler
-
 At tage konkrete skridt mod lavere kuldioxidemissionerEt forskerhold fra Princeton ledet af professor Claire White hjælper med at udvikle nye materialer, der fungerer lige så godt som cement, men som drastisk reducerer kulstofemissioner relateret til cem
At tage konkrete skridt mod lavere kuldioxidemissionerEt forskerhold fra Princeton ledet af professor Claire White hjælper med at udvikle nye materialer, der fungerer lige så godt som cement, men som drastisk reducerer kulstofemissioner relateret til cem -
 Et konkret skridt mod netto-nul kulstofemissioner i cementproduktionKredit:ElRoi, Shutterstock Som det mest udbredte byggemateriale, beton er uundværligt i udviklingen af infrastruktur, industri og boliger. Det er en blanding af tilslag (sand, grus, knust sten),
Et konkret skridt mod netto-nul kulstofemissioner i cementproduktionKredit:ElRoi, Shutterstock Som det mest udbredte byggemateriale, beton er uundværligt i udviklingen af infrastruktur, industri og boliger. Det er en blanding af tilslag (sand, grus, knust sten), -
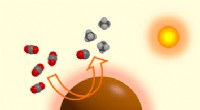 Elementært bor er en effektiv fototermokatalysator til omdannelse af kuldioxidEn selvopvarmende borkatalysator, der gør særlig effektiv brug af sollys til at reducere kuldioxid (CO2), fungerer som en let høstmaskine, fototermisk konverter, brintgenerator, og katalysator i ét. I
Elementært bor er en effektiv fototermokatalysator til omdannelse af kuldioxidEn selvopvarmende borkatalysator, der gør særlig effektiv brug af sollys til at reducere kuldioxid (CO2), fungerer som en let høstmaskine, fototermisk konverter, brintgenerator, og katalysator i ét. I -
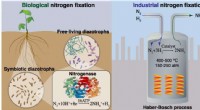 Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k
Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k
- Geofysiker teams med matematikere for at beskrive, hvordan floden klipper rundt
- Tyskland opfordrer til global minimumsskat for digitale giganter
- Hvad er det ikke -videnskabelige ord for mikroorganismer?
- Hvad hedder videnskaben ottende klasse?
- Hvor mange kromosomer er der i en gibbon -sædcelle?
- Hvorfor har faldende genstande en maksimal hastighed?


