Hvad er reduktionen af klor?
Her er en sammenbrud af reaktionen:
* klor (CL₂) er et neutralt molekyle med en oxidationstilstand på 0.
* reduktion involverer gevinsten af elektroner, hvilket resulterer i et fald i oxidationstilstand.
* I dette tilfælde får klor et elektron pr. Atom til at danne en chloridion (CL⁻) med en oxidationstilstand på -1.
Eksempel:
Reaktionen af klor med natriummetal (Na) til dannelse af natriumchlorid (NaCl) er et klassisk eksempel på chlorreduktion:
`` `
2NA (S) + CL₂ (G) → 2NACL (S)
`` `
Forklaring:
* I denne reaktion reduceres klor (CL₂) til chloridioner (CL⁻).
* Hvert kloratom får en elektron, hvilket resulterer i et fald i oxidationstilstand fra 0 til -1.
* Natrium (Na) oxideres til natriumioner (Na⁺) og mister et elektron pr. Atom.
Andre måder at reducere klor:
Klor kan også reduceres på andre måder, såsom:
* elektrolyse: Påføring af en elektrisk strøm på en opløsning, der indeholder chloridioner, kan forårsage, at chloridionerne får elektroner og danner klorgas.
* reaktion med reduktionsmidler: Visse reduktionsmidler som brint (H₂) eller zink (Zn) kan reagere med klor for at danne chloridioner.
Kortfattet:
Reduktionen af klor involverer forstærkning af elektroner ved kloratomer, hvilket resulterer i dannelse af chloridioner (CL⁻). Denne proces er vigtig i forskellige kemiske reaktioner og industrielle processer.
 Varme artikler
Varme artikler
-
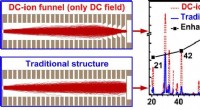 Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer
Forbedring af iontransmissionseffektiviteten af massespektrometreFokuseringseffekt af DC-ion-tragten. Kredit:Zhang Qiangling En nylig undersøgelse foretaget af forskere fra Hefei Institutes of Physical Science og offentliggjort i Analytical Chemistry præsenterer -
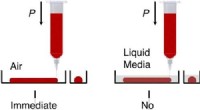 En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik
En simpel metode til at printe plane mikrostrukturer af polysiloxanKredit:Singapore University of Technology and Design Polysiloxan er en elastisk polymer, der er meget udbredt i fluidics, optik, og biomedicinsk teknik. Det tilbyder ønskværdige egenskaber til mik -
 Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang
Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang -
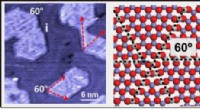 Atomfejllinjer undertrykker deaktivering af jernoxidkatalysatorer(Venstre) Et omgivende tryk-scannende tunnelmikroskopbillede af jernoxid (FeO) på en guldoverflade. (Mellem) En illustration, der viser dislokationslinjer lavet af jernatomer (grå), omgivet af fire il
Atomfejllinjer undertrykker deaktivering af jernoxidkatalysatorer(Venstre) Et omgivende tryk-scannende tunnelmikroskopbillede af jernoxid (FeO) på en guldoverflade. (Mellem) En illustration, der viser dislokationslinjer lavet af jernatomer (grå), omgivet af fire il


