Hvordan er aluminium og natrium forskellig fra hinanden?
1. Atomstruktur og egenskaber:
* aluminium (AL): Har 13 protoner, 13 elektroner og 14 neutroner (i sin mest almindelige isotop). Det er et post-transition metal placeret i gruppe 13 i den periodiske tabel. Aluminium er relativt lys , stærk og modstandsdygtig over for korrosion På grund af et beskyttende oxidlag, der dannes på dets overflade.
* natrium (NA): Har 11 protoner, 11 elektroner og 12 neutroner (i sin mest almindelige isotop). Det er et alkali metal placeret i gruppe 1 i den periodiske tabel. Natrium er blød, sølvhvid og meget reaktiv med vand og luft.
2. Reaktivitet:
* aluminium: Mens det er reaktivt, gør aluminiums oxidlag det relativt ureaktiv Ved stuetemperatur. Det reagerer med syrer, men ikke med baser.
* natrium: Ekstremt reaktiv, selv med luft og vand. Det reagerer voldsomt med vand og frigiver brintgas og varme. Det reagerer med syrer og baser.
3. Anvendelser:
* aluminium: Meget brugt i byggeri, transport, emballage og forbrugsvarer på grund af dens lethed, styrke og modstand mod korrosion.
* natrium: Brugt i forskellige industrielle processer som fremstilling af natriumhydroxid, natriumchlorid (bordsalt) og natriumlamper. Det bruges også i batterier og som et varmeoverførselsmedium.
4. Udseende:
* aluminium: Silvery-grå i farve, typisk kedelig på grund af oxidlaget.
* natrium: Silvery-hvid, meget reaktivt metal, der hurtigt pletter i luften.
5. Fysiske egenskaber:
* aluminium: Smeltepunkt:660,32 ° C (1220,58 ° F), kogepunkt:2519 ° C (4566 ° F), densitet:2,70 g/cm3
* natrium: Smeltepunkt:97,72 ° C (207,90 ° F), kogepunkt:883 ° C (1621 ° F), densitet:0,97 g/cm3
Kortfattet: Aluminium er et stærkt, holdbart metal med et beskyttende oxidlag, mens natrium er et blødt, meget reaktivt metal. Deres forskelle i reaktivitet, anvendelser og fysiske egenskaber skyldes deres forskellige atomstrukturer og positioner på den periodiske tabel.
Sidste artikelHvad er to måder, hvorpå mineraler kan dannes fra en løsning?
Næste artikelEr ilt mere elektronaffinitet end svovl?
 Varme artikler
Varme artikler
-
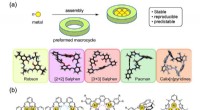 Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall
Metalliske komplekser lavet af cykliske molekylerModerne makrocykler brugt til syntese af diskrete polymetalliske komplekser:(a) koncept, (b) kemiske strukturer af repræsentative polymetalliske komplekser. Kredit:Kanazawa University I polymetall -
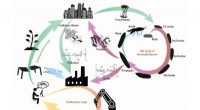 Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol
Team udvikler manglende led til cirkulær økonomi, mens de tackler globalt affaldSkematisk over det udviklede lukkede produktionskredsløb baseret på bioinspirerede kitinholdige materialer og biokonvertering i et bymiljø. Kredit:SUTD Forskere fra Singapore University of Technol -
 Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S
Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S -
 Potentielle assay-artefakter i anti-malaria screeningRepræsentativt billede af in vitro -lægemiddelscreening mod malariaparasit, Plasmodium . Kredit:Renugah Naidu og Gowtham Subramanian, Singapore University of Technology &Design Malaria er fortsa
Potentielle assay-artefakter i anti-malaria screeningRepræsentativt billede af in vitro -lægemiddelscreening mod malariaparasit, Plasmodium . Kredit:Renugah Naidu og Gowtham Subramanian, Singapore University of Technology &Design Malaria er fortsa


