Kan gaslove bruges med afbalancerede kemiske ligninger til beregning af mængden af en gasformig reaktant eller et produkt som reaktion?
processen
1. afbalanceret kemisk ligning: Du har brug for en afbalanceret kemisk ligning for reaktionen for at bestemme molforholdene mellem reaktanter og produkter.
2. Identificer de gasformige arter: Identificer den gasformige reaktant eller et produkt, du vil beregne mængden af.
3. Brug ideel gaslov (eller anden relevant gaslov): Den ideelle gaslov (PV =NRT) bruges ofte til at relatere tryk (P), volumen (V), antal mol (N), temperatur (T) og den ideelle gaskonstant (R). Du kan bruge denne lov til at finde den ukendte mængde (f.eks. Gasvolumen produceret), hvis du kender de andre variabler.
4. relaterer mol til den kemiske ligning: Brug molforholdene fra den afbalancerede ligning til at omdanne mellem mol af gas og mol af andre reaktanter eller produkter.
eksempel
Lad os sige, at vi ønsker at finde mængden af brintgas (H₂) produceret ved en bestemt temperatur og tryk, når 2,0 gram magnesium (Mg) reagerer fuldstændigt med saltsyre (HCI):
afbalanceret ligning:
MG (S) + 2HCI (AQ) → MGCL₂ (AQ) + H₂ (G)
trin:
1. Konverter gram Mg til mol:
* Molmasse Mg =24,31 g/mol
* Mol mg =2,0 g / 24,31 g / mol =0,082 mol
2. Bestem molen af h₂ produceret:
* Fra den afbalancerede ligning producerer 1 mol Mg 1 mol H₂.
* Mol H₂ =0,082 mol
3. Brug den ideelle gaslov:
* Antag, at du kender temperaturen (t) og tryk (p), hvor reaktionen opstår.
* Omarranger den ideelle gaslov til at løse for volumen (v):v =nrt/p
* Tilslut værdierne for N, R, T og P for at beregne mængden af produceret H₂.
Vigtige overvejelser:
* Anvendelighed af gaslov: Den ideelle gaslov fungerer godt for mange gasser under normale forhold. Imidlertid afviger reelle gasser fra ideel opførsel ved høje tryk eller lave temperaturer.
* støkiometri: Den afbalancerede kemiske ligning er afgørende for nøjagtige molforhold.
* enheder: Sørg for, at alle enheder er konsistente (f.eks. Liter for volumen, atmosfærer for tryk, Kelvin for temperatur).
Fortæl mig, hvis du har en bestemt reaktion i tankerne, og jeg kan hjælpe dig med at arbejde gennem beregningen!
 Varme artikler
Varme artikler
-
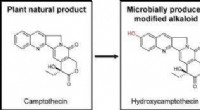 Mikrober kunne gøre medicinproduktionen mere effektivAlkaloidbaserede lægemidler afledt af planter kan være potente behandlinger for en række forskellige sygdomme. Men at få disse kraftfulde terapeutiske midler fra planter kan tage lang tid og koste man
Mikrober kunne gøre medicinproduktionen mere effektivAlkaloidbaserede lægemidler afledt af planter kan være potente behandlinger for en række forskellige sygdomme. Men at få disse kraftfulde terapeutiske midler fra planter kan tage lang tid og koste man -
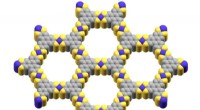 En ny miniatureløsning til lagring af vedvarende energiDen kobolt-baserede metal-organiske ramme brugt af USC-forskerne, med lilla, der repræsenterer kobolt, gul repræsenterer svovl og grå repræsenterer kulstof. Kredit:Smaranda Marinescu Forskere har
En ny miniatureløsning til lagring af vedvarende energiDen kobolt-baserede metal-organiske ramme brugt af USC-forskerne, med lilla, der repræsenterer kobolt, gul repræsenterer svovl og grå repræsenterer kulstof. Kredit:Smaranda Marinescu Forskere har -
 Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet -
 En verdens første inden for cirkadisk urmanipulationTrans- og cis -isomerer af azobensen bestemmer ændringen i døgnperioden gennem deres interaktion med CRY1 -urgenet Kredit:Issey Takahashi Nagoya University Institute of Transformative Bio-Molecule
En verdens første inden for cirkadisk urmanipulationTrans- og cis -isomerer af azobensen bestemmer ændringen i døgnperioden gennem deres interaktion med CRY1 -urgenet Kredit:Issey Takahashi Nagoya University Institute of Transformative Bio-Molecule
- Vinden tiltager, mens brandmænd kæmper mod brand i Californien
- Rekonfigurerbar struktur og afstembar transport i synkroniserede aktive spinnermaterialer
- Glow-in-the-mørke papir som en hurtig test for infektionssygdomme
- Hvordan bruges syrer og baser i industrien?
- Hvordan bruges vind til at generere energi?
- Opdagelse i det tidlige univers stiller sort huls vækstpuslespil


