Hvor mange gram fast bariumsulfat dannes, når 22,6 ml 0,160 M -chlorid reagerer med 54,6 0,055 natriumsulfat?
1. Skriv den afbalancerede kemiske ligning:
Bacl₂ (aq) + na₂so₄ (aq) → Baso₄ (s) + 2naCl (aq)
2. Beregn molen for hver reaktant:
* mol Bacl₂:
(22,6 ml) * (1 l / 1000 ml) * (0,160 mol / l) =0,00362 mol bacl₂
* mol na₂so₄:
(54,6 ml) * (1 l / 1000 ml) * (0,055 mol / l) =0,00300 mol Na₂so₄
3. Bestem den begrænsende reaktant:
* Den afbalancerede ligning viser et forhold på 1:1 mol mellem bacl₂ og na₂so₄.
* Da vi har færre mol na₂so₄ (0,00300 mol) end bacl₂ (0,00362 mol), er Na₂so₄ den begrænsende reaktant. Dette betyder, at det vil blive konsumeret fuldstændigt, og mængden af dannet baso₄ vil blive bestemt af mængden af na₂so₄.
4. Beregn molen af baso₄ dannet:
* 1:1 molforhold fra den afbalancerede ligning fortæller os, at 0,00300 mol Na₂so₄ vil producere 0,00300 mol baso₄.
5. Konverter mol af baso₄ til gram:
* Molmasse af baso₄ =137,33 g/mol + 32,06 g/mol + (4 * 16,00 g/mol) =233,39 g/mol
* Masse af baso₄ =(0,00300 mol) * (233,39 g/mol) = 0,700 g
Derfor dannes 0,700 gram fast bariumsulfat.
 Varme artikler
Varme artikler
-
 Bladvenestruktur kan være nøglen til at forlænge batteriets levetidNærbillede af et blad, der viser sine årer. Kredit:Christoph Rupprecht/Flickr Den naturlige struktur, der findes i blade, kan forbedre alt fra genopladelige batterier til højtydende gassensorer, i
Bladvenestruktur kan være nøglen til at forlænge batteriets levetidNærbillede af et blad, der viser sine årer. Kredit:Christoph Rupprecht/Flickr Den naturlige struktur, der findes i blade, kan forbedre alt fra genopladelige batterier til højtydende gassensorer, i -
 Krystalkrige:Forskning kan føre til mere effektive krystalteknologiske metoderForskere ved University of Tokyo og Fudan University bruger konfokal mikroskopi til at observere polymorf krystallisation i hidtil usete detaljer. Kredit:Institut for Industrividenskab, universitetet
Krystalkrige:Forskning kan føre til mere effektive krystalteknologiske metoderForskere ved University of Tokyo og Fudan University bruger konfokal mikroskopi til at observere polymorf krystallisation i hidtil usete detaljer. Kredit:Institut for Industrividenskab, universitetet -
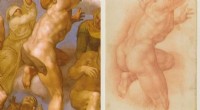 Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra
Ny hydrogel udviklet til at fjerne tape fra århundreder gammel tegning(Venstre) Detalje fra Ascesa dei Beati (Michelangelo Buonarroti) fra Det Sixtinske Kapel; (Til højre) tegning fra 1500-tallet, der gengiver den samme detalje. En indskrift di mano di Michelangelo (fra -
 Hydrogenudvindingsgennembrud kan være game-changerElektronmikroskopbillede viser legeringen, der deler vand. Kredit:KTH Det Kongelige Teknologiske Institut Forskere ved KTH Royal Institute of Technology har med succes testet et nyt materiale, der
Hydrogenudvindingsgennembrud kan være game-changerElektronmikroskopbillede viser legeringen, der deler vand. Kredit:KTH Det Kongelige Teknologiske Institut Forskere ved KTH Royal Institute of Technology har med succes testet et nyt materiale, der


