Hvorfor er smeltepunktet for licl lavere end NaCl?
1. Ionisk størrelse og ladningstæthed:
* li+ er mindre end Na+: Mindre ioner har højere ladningstæthed (opladning pr. Enhedsvolumen). Dette fører til stærkere elektrostatiske attraktioner mellem ionerne i LICL.
* cl- er den samme størrelse i begge forbindelser: Størrelsen på anionen ændrer ikke signifikant forskel på ladetætheden.
2. Polariserbarhed:
* Li+ er mere polariserbar end Na+: Polariserbarhed henviser til den lethed, hvormed en ion's elektronsky kan forvrænges af det elektriske felt i de nærliggende ioner. Mindre ioner er generelt mindre polariserbare.
3. Gitter Energi:
* licl har en lavere gitterenergi end NaCl: Gitterenergi er den energi, der kræves for at adskille en mol af en ionisk forbindelse i dens gasformige ioner. Det er direkte relateret til styrken af den elektrostatiske tiltrækning mellem ionerne.
4. Kovalent karakter:
* licl har en højere kovalent karakter end NaCl: På grund af den mindre størrelse og højere ladningstæthed af Li+har LI-CL-bindingen en større grad af kovalent karakter, der svækker de ioniske interaktioner og sænker smeltepunktet.
Kortfattet:
Den mindre størrelse og højere ladningstæthed af Li+ i LICL sammenlignet med Na+ i NaCl -resultater i:
* Stærkere elektrostatisk tiltrækning inden for LICL -gitteret, men
* Større polariserbarhed af Li+, hvilket fører til et mindre stabilt gitter.
Den kombinerede effekt er en lavere gitterenergi for LICL, hvilket resulterer i et lavere smeltepunkt end NaCl.
 Varme artikler
Varme artikler
-
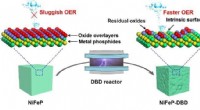 Ætseprocessen øger udvindingen af brint under vandelektrolyseSkematisk diagram over ætsningsprocessen, der anvendes på metalphosphidelektrokatalysatorer. Kredit:Forfatterne Udvinding af brint fra vand gennem elektrolyse er en lovende vej til at øge produkti
Ætseprocessen øger udvindingen af brint under vandelektrolyseSkematisk diagram over ætsningsprocessen, der anvendes på metalphosphidelektrokatalysatorer. Kredit:Forfatterne Udvinding af brint fra vand gennem elektrolyse er en lovende vej til at øge produkti -
 Hvordan en krystallinsk svamp udskiller vandmolekylerEt mikroskopbillede, der viser en porøs, krystallinsk materiale kaldet en metal-organisk ramme, eller MOF (materialet i lilla). Denne MOF er lavet af kobolt(II)sulfatheptahydrat, 5-aminoisophthalsyre
Hvordan en krystallinsk svamp udskiller vandmolekylerEt mikroskopbillede, der viser en porøs, krystallinsk materiale kaldet en metal-organisk ramme, eller MOF (materialet i lilla). Denne MOF er lavet af kobolt(II)sulfatheptahydrat, 5-aminoisophthalsyre -
 En luftstabil og vandtæt lithiummetalanodeDiagram over Li-wax-PEO og dens stabilitet i luft og vand. Kredit:Science China Press Lithiummetalanode tilbyder en lovende vej til at opgradere energitætheden af lithium-ion-batterier på grund
En luftstabil og vandtæt lithiummetalanodeDiagram over Li-wax-PEO og dens stabilitet i luft og vand. Kredit:Science China Press Lithiummetalanode tilbyder en lovende vej til at opgradere energitætheden af lithium-ion-batterier på grund -
 Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor
Teknologi, der forudsiger proteinstabilitet, er frigivet af det britiske universitets spin-out selsk…QUBES tager et fingeraftryk af proteinfluorescens og konverterer det til en forudsigelse af proteinstabilitet samt overvågning for ændringer i proteinstruktur. QUBES er en cloud-hostet softwareplatfor
- Hvordan er mennesker tilpasset erosion?
- Påvirkninger af store vulkanudbrud gennem de sidste to årtusinder på både globale og kinesiske k…
- Smart lægemiddeldesign til at forhindre malariabehandlingsresistens
- En geolog vil finde ud af mere om en ny opdagelse inden for hans felt, hvilken type kilde skal han k…
- Hvad er de store ideer om videnskab?
- Hvordan adskiller man ammoniumchlorid fra en blanding, der indeholder natrium og ammoniumchlorid?


