Hvad har vandmolekyler i luften en tendens til at holde sig til?
1. Andre vandmolekyler: Vandmolekyler tiltrækkes af hinanden gennem hydrogenbinding, en type intermolekylær kraft. Denne attraktion er det, der får vand til at danne dråber og skyer.
2. Overflader med polære molekyler: Vand er et polært molekyle, hvilket betyder, at det har en lidt positiv ende og en lidt negativ ende. Dette giver det mulighed for at danne brintbindinger med andre polære molekyler, ligesom dem, der findes på overfladen af:
* Støvpartikler: Disse kan består af forskellige materialer, herunder salte, jord og organisk stof, som alle kan have polære molekyler.
* saltkrystaller: Salt er et meget polært molekyle, og vand tiltrækkes stærkt af det. Dette er grunden til, at salt let opløses i vand.
* Visse typer metal og glas: Disse overflader kan have polære molekyler på grund af deres atomstruktur.
3. Overflader med høj overfladespænding: Vandmolekyler tiltrækkes også af overflader med høj overfladespænding, såsom:
* Hydrofobe materialer: Disse materialer, som voks og olier, afviser vand, men de har stadig en høj overfladespænding. Dette betyder, at vandmolekyler vil have en tendens til at klynge sig sammen på disse overflader i stedet for at sprede sig ud.
4. Ladede overflader: Vandmolekyler tiltrækkes af ladede overflader, ligesom dem, der findes på:
* ioner: Disse er ladede atomer eller molekyler, der tiltrækkes af vandmolekyler.
* ladede polymerer: Dette er lange kæder af molekyler, der har en nettoafgift, og de kan tiltrække vandmolekyler.
5. Kondensationkerner: Dette er små partikler i luften, som støv, pollen eller havsalt, der giver en overflade til vanddamp at kondensere til og danne skydråber.
Det er vigtigt at huske, at i hvilket omfang vandmolekyler klæber til en bestemt overflade afhænger af mange faktorer, herunder temperatur, fugtighed og arten af selve overfladen.
 Varme artikler
Varme artikler
-
 Forskere udvikler tilgang til vedvarende energi til fremstilling af ammoniakWilliam Schneider. Kredit:University of Notre Dame Forskere ved University of Notre Dame udvikler en tilgang til vedvarende energi til at syntetisere ammoniak, en væsentlig komponent af gødning, d
Forskere udvikler tilgang til vedvarende energi til fremstilling af ammoniakWilliam Schneider. Kredit:University of Notre Dame Forskere ved University of Notre Dame udvikler en tilgang til vedvarende energi til at syntetisere ammoniak, en væsentlig komponent af gødning, d -
 Varme vibrerende gasser under elektronens spotlightSkematisk illustration af dynamisk opførsel af gasformige molekyler observeret ved hjælp af elektronmikroskopi. Kredit:University of Tokyo Naturgas bruges i raffinaderier som grundlag for produkte
Varme vibrerende gasser under elektronens spotlightSkematisk illustration af dynamisk opførsel af gasformige molekyler observeret ved hjælp af elektronmikroskopi. Kredit:University of Tokyo Naturgas bruges i raffinaderier som grundlag for produkte -
 Udvikling af enzymer til at hjælpe med at løse planetens plastikproblemKredit:Unsplash/CC0 Public Domain Forskere fra Manchester Institute of Biotechnology (MIB) har udviklet en ny enzymteknologisk platform til at forbedre plastnedbrydende enzymer gennem rettet evolut
Udvikling af enzymer til at hjælpe med at løse planetens plastikproblemKredit:Unsplash/CC0 Public Domain Forskere fra Manchester Institute of Biotechnology (MIB) har udviklet en ny enzymteknologisk platform til at forbedre plastnedbrydende enzymer gennem rettet evolut -
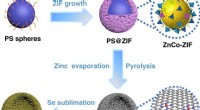 Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite
Team afslører en enkel metode til at producere højtydende lithium-selenbatterierSAC forberedelsesproces. Kredit: Naturkommunikation (2020). DOI:10.1038/s41467-020-18820-y Genopladelige lithium-ion-batterier (LIBer) betragtes som det bedste håb for næste generations batterite
- Hvor meget energi frigives, når 42,5 g aluminiumdamp afkøles fra 4750 grader Celsius til 25 Celsiu…
- Zoom for at fokusere på sikkerhed, privatliv, CEO siger, som brug boomer under coronakrisen
- Anslagskratere afslører detaljer om Titans dynamiske overfladeforvitring
- Hvilket kontinent ligger helt nord for ækvator og østprim Meridian?
- Hvorfor kan vi se solen, men ikke høre den?
- Hvilken planet har bjerge dals sletter og kontinenter, men ikke vand?


