Reagerer syre med aluminium for at producere brintgas?
reaktionen:
* aluminium (AL) + syre (H +) → aluminiumsalt + brintgas (H2)
Hvad sker der:
* Aluminium er et reaktivt metal.
* Når det kommer i kontakt med en syre, reagerer syrens hydrogenioner (H+) med aluminiumet.
* Denne reaktion frigiver elektroner fra aluminiumatomerne og danner aluminiumioner (Al3+).
* De frigivne elektroner kombineres derefter med brintioner for at danne brintgas (H2).
Vigtige overvejelser:
* Syrestyrke: Stærkere syrer, som saltsyre (HCI) og svovlsyre (H2SO4), reagerer mere kraftigt med aluminium end svagere syrer, som eddikesyre (eddike).
* tilstedeværelse af et oxidlag: Aluminium danner naturligt et beskyttende oxidlag på dets overflade. Dette lag kan bremse eller forhindre reaktionen, især med svagere syrer.
* Betingelser: Temperatur og koncentrationen af syren påvirker også reaktionshastigheden.
Eksempel:
* Hvis du placerer et stykke aluminiumsfolie i saltsyre, vil du se bobler af brintgas, der dannes på overfladen af aluminiumet. Løsningen bliver også varm, når reaktionen frigiver varme.
sikkerhed:
* Vær forsigtig, når du arbejder med syrer og metaller, da reaktionen kan være eksoterm (producere varme) og kan føre til ætsende dampe.
* Brug altid passende sikkerhedsudstyr og arbejd i et godt ventileret område.
Fortæl mig, hvis du har flere spørgsmål om denne reaktion!
Sidste artikelHvad opløses ikke -metaloxider i vand for at dannes?
Næste artikelHvad betyder abiotisk syntese?
 Varme artikler
Varme artikler
-
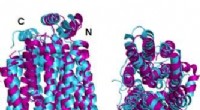 Ny forskning transformerer glukosetransportproteiner til vandopløselig formTo vinkler af den krystallinske struktur GLUT1 (magenta) glucosetransporterprotein overlejret med den AlphaFold2 computerforudsagte vandopløselige variant af det samme protein (cyan) viser, at det kry
Ny forskning transformerer glukosetransportproteiner til vandopløselig formTo vinkler af den krystallinske struktur GLUT1 (magenta) glucosetransporterprotein overlejret med den AlphaFold2 computerforudsagte vandopløselige variant af det samme protein (cyan) viser, at det kry -
 Forskere udvikler et effektivt system til levering af biomateriale til laboratorierKredit:National University of Science and Technology MISIS Materialeforskere fra NUST MISIS, sammen med kolleger fra Institut for Kemi ved Lomonosov Moscow State University, har udviklet en billig
Forskere udvikler et effektivt system til levering af biomateriale til laboratorierKredit:National University of Science and Technology MISIS Materialeforskere fra NUST MISIS, sammen med kolleger fra Institut for Kemi ved Lomonosov Moscow State University, har udviklet en billig -
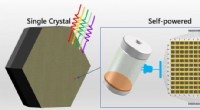 Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione
Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione -
 Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell
Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell


