Ny forskning transformerer glukosetransportproteiner til vandopløselig form
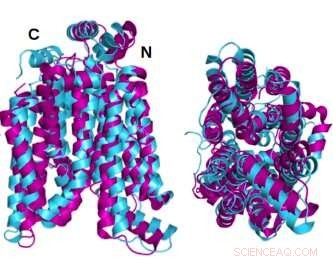
To vinkler af den krystallinske struktur GLUT1 (magenta) glucosetransporterprotein overlejret med den AlphaFold2 computerforudsagte vandopløselige variant af det samme protein (cyan) viser, at det krystallinske protein og dets vandopløselige QTY-variant deler bemærkelsesværdig strukturel lighed. Kredit:Shuguang Zhang Laboratory, MIT
Alle cellemembraner i den menneskelige krop har indlejrede proteiner, der fungerer som sensorer, budbringere eller som et middel til at transportere og regulere stoffer, der går ind og ud af cellen. Især transportproteiner er dårligt forstået på grund af deres strukturelle kompleksitet og deres hydrofobe natur, der gør dem modstandsdygtige over for studier. Samtidig spiller disse transportproteiner, især dem der regulerer glukose, en afgørende rolle i væksten af kræftsvulster.
I en ny undersøgelse har forskere ledet af Dr. Shuguang Zhang, Ph.D. fra MIT Media Lab, demonstrere en metode til hurtigt at forudsige designet af hydrofile variantstrukturer af de 14 glucosetransportmembranproteiner i celler. Dette vil give forskere mulighed for lettere at studere proteinerne i vand. Forskerne bekræfter nøjagtigheden af de forudsagte strukturer ved at sammenligne dem med allerede eksisterende krystallografiske billeder af to af proteinerne.
De håber, at en øget forståelse af disse glukosetransportproteiner vil fremskynde udviklingen af terapeutiske monoklonale antistoffer til behandling af cancermetastaser. Dette ville i det væsentlige udsulte kræftceller ved at blokere glukosetransportører.
"De fleste kræftceller øger markant deres ekspression og produktion af glukosetransportere, kaldet GLUT'er, for deres umættelige energibehov," siger Eva Smorodina, en bachelorstuderende i strukturel biologi ved Greiff Lab, Universitetet i Oslo, som er førsteforfatter til en artikel om undersøgelsen offentliggjort 27. juni i QRB Discovery . "I øjeblikket er der næsten ingen effektive lægemidler til at blokere GLUT'er, da de har en udfordrende struktur."
GLUT'ernes komplekse strukturer omfatter 12 transmembrane hydrofobe helixer indlejret i membranen. I deres native eller krystallinske tilstand skal de hydrofobe strukturer placeres i et specielt vaskemiddel eller reagens til laboratorieundersøgelser, ellers mister de deres struktur. Og med proteiner er struktur og funktion uudsletteligt forbundet.
"At studere disse proteiner i vaskemiddel er som at bære tunge handsker til at samle et dyrt ur eller spille på en violin," siger Dr. Zhang, en af de få biomedicinske videnskabsmænd, for hvem studiet af membranproteiner er lige så overbevisende, som det er afgørende for vores forståelse. af kræftceller. Han begyndte først at arbejde på membranproteiner i begyndelsen af 2000'erne. "Få mennesker studerede disse membranproteiner," siger Dr. Zhang. "De er som en varm kartoffel," siger han på grund af deres iboende modstand mod at studere.
Det nye arbejde er baseret på Dr. Zhangs succes for fire år siden, da han og et team opnåede det, Dr. Zhang havde arbejdet på i næsten et årti:De designede en smuk enkel metode kaldet QTY-koden til at transformere et hydrofobt cellemembranprotein til et hydrofilt protein ved at substituere mange hydrofobe aminosyrer.
QTY-koden er opkaldt efter symbolerne for de tre aminosyrer - glutamin (Q), threonin (T) og tyrosin (Y) - der erstatter fire hydrofobe aminosyrer:leucin (L), isoleucin (I), valin ( V) og phenylalanin (F). Ingen af disse aminosyrer bærer en ladning, som gør substitutionen godartet. Struktur er afgørende for proteinernes funktion, og substitutionen ændrer ikke strukturen.
I den seneste undersøgelse anvender Dr. Zhang og teamet QTY-koden på de 14 glukosetransportmembranproteiner, der transporterer sukker til celler. De brugte det nye AlphaFold2-program, et kunstig intelligens-baseret beregningsprogram udviklet af virksomheden DeepMind, der præcist og hurtigt kan forudsige, hvordan proteiner folder. Dr. Zhang og team brugte QTY-koden med open source AlphaFold2 til at forudsige alfa-spiralformerne af de 14 GLUT-proteiner i både deres naturlige hydrofobe former og deres QTY-kode ændrede vandopløselige former.
De krystallinske eller native tilstandsstrukturer af to af GLUT'erne - 1 og 3 - var tidligere blevet afsløret af andre forskere ved hjælp af røntgenkrystallografi. For at underbygge deres egen metodologi forudsagde Dr. Zhangs team først den hydrofile struktur af disse to GLUT'er ved at anvende QTY-kodens aminosyreerstatninger og lade AlphaFold2 forudsige proteinernes former. Det gjorde den med stor nøjagtighed. De overlejrede hydrofobe og hydrofile billeder er næsten identiske.
Holdet fulgte op på denne bekræftelse ved at kombinere QTY-kode og AlphaFold2 for at forudsige de hydrofile strukturer af de 12 andre GLUT'er - på rekordtid. "I 2018 tog det fire til fem uger at bruge en højhastighedscomputerklynge til at simulere enhver proteinstruktur," siger Dr. Zhang. "Nu med AlphaFold2 kan vi bruge en Google-computer gratis, og den simulerer de transmembrane proteiner i timer. Nogle små proteiner tog mindre end en time."
"Denne undersøgelse af humane membranglukosetransportører og deres vandopløselige QTY-varianter fra Zhang-laboratoriet ved MIT er fascinerende," siger professor Joel Sussman fra Weizmann Institute of Science i Rehovot, Israel, som ikke var involveret i arbejdet. "Det giver eksperimentel visualisering via røntgenkrystallografi og AI-forudsigelse ved hjælp af AlphaFold2 til for første gang ved atomopløsning at se forskellene mellem hydrofobe 'vandhadende' helixer og hydrofile 'vandelskende' helixer. Det er en kritisk step in using the QTY code method to study multispan transmembrane proteins and other aggregated proteins through their water-soluble variants, and is likely to have an enormous impact in the field of biotechnology."
MIT Professor Robert Langer, whose work in biomedical engineering is highly celebrated, says, "The [QRB Discovery ] paper is excellent, and I believe has the potential to help a lot of cancer patients." Professor Langer was not involved in the research.
Authors of the QRB Discovery paper are Dr. Zhang and Smorodina; Fei Tao and Rui Qing of Shanghai Jiaotong University (Dr. Qing was previously a postdoctoral researcher in the MIT Media Lab and later a research scientist at the Koch Institute for Integrative Cancer Research at MIT); Dr. Steve Yang an MIT alumnus now at PT Metiska Farma in Indonesia; and Dr. David Jin, M.D., Ph.D. of Avalon GloboCare Corp., who stimulated Dr. Zhang to apply the QTY code to the study of cancer cells. Avalon GloboCare also funded the research.
Dr. Jin says he hopes—but this is not part of the current study—that future research will be able to genetically alter the glucose passage membranes to develop novel therapeutic targets.
"Now our only choices for cancer treatment are surgery, chemo or small-molecule therapy," says Dr. Jin. "In future, it may be possible to take a patient's T-cell, a component of the immune system, and genetically modify it in the lab so that it can work almost like a cancer-searching GPS system with a tumor-attacking capability." + Udforsk yderligere
Scientists alter membrane proteins to make them easier to study
 Varme artikler
Varme artikler
-
 Ny teknologi til patogendetektion drevet af laserePurdue innovatører har udviklet et lanthanid-baseret assay kombineret med en laser, der kan bruges til at påvise toksiner og patogene E. coli i fødevareprøver, vand og en række industrielle materialer
Ny teknologi til patogendetektion drevet af laserePurdue innovatører har udviklet et lanthanid-baseret assay kombineret med en laser, der kan bruges til at påvise toksiner og patogene E. coli i fødevareprøver, vand og en række industrielle materialer -
 Naturens slik:Lån af en naturlig opskrift på sukkersynteseKredit:CC0 Public Domain I dag, sukker har et skurkagtigt ry. Og selvom for meget af de søde sager bør undgås, alle levende ting har brug for sukker for at overleve. Det biologiske univers er bela
Naturens slik:Lån af en naturlig opskrift på sukkersynteseKredit:CC0 Public Domain I dag, sukker har et skurkagtigt ry. Og selvom for meget af de søde sager bør undgås, alle levende ting har brug for sukker for at overleve. Det biologiske univers er bela -
 Ny teori viser, hvordan belastning giver bedre katalysatorerBrown University forskere har vist, at virkningerne af ekstern belastning på en katalysator afhænger af den indre belastning, der udøves af kemiske reaktanter. Den nye teoretiske ramme kunne være nytt
Ny teori viser, hvordan belastning giver bedre katalysatorerBrown University forskere har vist, at virkningerne af ekstern belastning på en katalysator afhænger af den indre belastning, der udøves af kemiske reaktanter. Den nye teoretiske ramme kunne være nytt -
 Ny separationsproces for nøgleradiodiagnostisk middel reducerer radioaktivt affaldDr. Tobias Chemnitz på testfaciliteten for Mo-99 produktion på FRM II på Garching forskningscampus. Kredit:Reiner Müller, FRM II / TUM Nuklearmedicin bruger blandt andet technetium-99m til tumordia
Ny separationsproces for nøgleradiodiagnostisk middel reducerer radioaktivt affaldDr. Tobias Chemnitz på testfaciliteten for Mo-99 produktion på FRM II på Garching forskningscampus. Kredit:Reiner Müller, FRM II / TUM Nuklearmedicin bruger blandt andet technetium-99m til tumordia
- Sådan forhindrer du byer i at tørre ud
- Hvad er affaldsproduktet af fotosyntese?
- Fejl i neutronstjerne afslører sine skjulte hemmeligheder
- Den utilsigtede konsekvens af online skolegang:Tab af kulturelle værdier
- Politikker, der menes at stabilisere det finansielle system, kan faktisk gøre det modsatte, undersø…
- Kunstig intelligens løser Schrödingers ligning


