Ny teori viser, hvordan belastning giver bedre katalysatorer
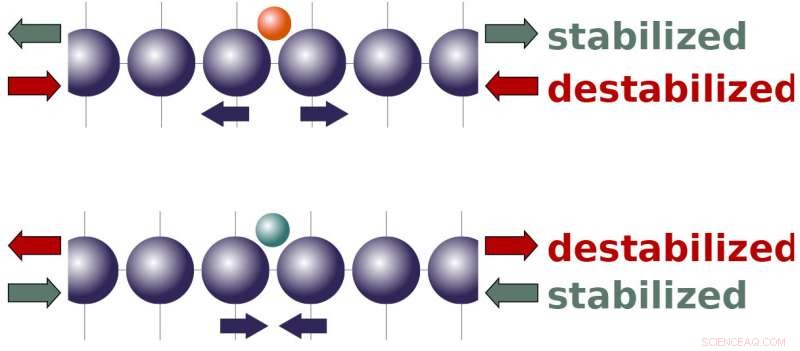
Brown University forskere har vist, at virkningerne af ekstern belastning på en katalysator afhænger af den indre belastning, der udøves af kemiske reaktanter. Den nye teoretiske ramme kunne være nyttig til at optimere katalysatorer til forskellige reaktioner. Kredit:Peterson lab / Brown University
Brown University-forskere har udviklet en ny teori for at forklare, hvorfor strækning eller komprimering af metalkatalysatorer kan få dem til at yde bedre. Teorien, beskrevet i journalen Naturkatalyse , kunne åbne nye designmuligheder for nye katalysatorer med nye muligheder.
Katalysatorer er stoffer, der fremskynder kemiske reaktioner. Langt størstedelen af industriel katalyse involverer faste overflader, ofte metaller, som katalyserer reaktioner i væsker eller gasser. En katalysator på en bil, for eksempel, bruger metalkatalysatorer til at plukke toksiner ud af udstødningsgasser. Der er også interesse i at bruge metalkatalysatorer til at omdanne kuldioxid til brændstoffer, lave gødning af atmosfærisk nitrogen og drive reaktioner i brændselscellebiler.
Forskning i de senere år har vist, at påføring af en belastning på metalkatalysatorer - enten kompression eller spænding - i nogle tilfælde kan ændre den måde, de yder på.
"Strain er et virkelig varmt emne i katalyse lige nu, " sagde Andrew Peterson, en adjunkt ved Brown's School of Engineering og medforfatter til forskningen. "Vi er begyndt at se ting ske under pres, som ikke let kan forklares af den traditionelle teori om, hvordan katalysatorer virker. Det fik os til at tænke på en alternativ ramme for dette spørgsmål."
En metalkatalysator virker ved at få reaktanter til at binde sig til dens overflade, en proces kendt som adsorption. Adsorption bryder kemiske bindinger af reaktantmolekylerne, gør det muligt for forskellige stadier af en kemisk reaktion at finde sted på metallets overflade. Efter at reaktionstrinene er afsluttet, slutproduktet frigives fra katalysatoren gennem den omvendte proces, kaldet desorption.
En katalysators nøgleegenskab er dens reaktivitet, betyder, hvor tæt det binder kemiske molekyler til sin overflade. Katalysatorer skal være noget reaktive for at binding kan ske, men ikke for reaktivt. For meget reaktivitet får katalysatoren til at holde molekyler for tæt, hvilket kan hindre nogle stadier af reaktionen eller gøre det, så slutprodukterne ikke kan desorbere.
Det er blevet vist i de senere år, at påføring af en stamme til en katalysator kan justere dens reaktivitet, og der er en veletableret teori for, hvordan det virker. Generelt sagt, teorien forudsiger, at trækspænding bør øge reaktiviteten, mens kompression skal reducere det. Imidlertid, Peterson og hans gruppe blev ved med at støde på systemer, der ikke let kan forklares af teorien.
Det fik forskerne til at tænke på en ny måde at se problemet på. Den traditionelle teori beskriver ting på niveau med elektroner og elektronbånd. Den nye teori zoomer lidt ud, fokuserer i stedet på mekanikken i, hvordan molekyler interagerer med en katalysators atomgitter.
Peterson og hans team viste, at molekyler bundet til en katalysators overflade vil have tendens til enten at skubbe atomer i gitteret fra hinanden eller trække dem tættere sammen, afhængig af egenskaberne af molekylerne og bindingsstederne. De forskellige kræfter produceret af molekyler har interessante implikationer for, hvordan ekstern belastning skal påvirke en katalysators reaktivitet. Det tyder på, at spænding, som strækker en katalysators atomgitter, skal gøre en katalysator mere reaktiv over for molekyler, der naturligt ønsker at skubbe gitteret fra hinanden. På samme tid, spænding bør mindske reaktiviteten for molekyler, der ønsker at trække gitteret sammen. Kompression - at klemme gitteret - har en omvendt effekt.
Den nye teori hjælper ikke kun med at forklare tidligere forvirrende resultater, det giver vigtige nye forudsigelser. Specifikt, den forudsiger en måde at bryde traditionelle skaleringsforhold mellem katalysatorer og forskellige typer molekyler.
"Skalering betyder, at under normale omstændigheder, når du øger en katalysators reaktivitet for et kemikalie, det øger også reaktiviteten for andre kemikalier, " sagde Peterson. "På samme måde, hvis du reducerer reaktiviteten for et kemikalie, du mindsker det for andre."
Disse skaleringsforhold forårsager besværlige afvejninger, når man forsøger at optimere en katalysator. At få den perfekte reaktivitet for et kemikalie kan få et andet kemikalie til at binde sig for tæt (eller for løst), potentielt hæmme nogle stadier af en reaktion. Men denne nye teori antyder, at belastning kan bryde disse skaleringsrelationer - hvilket gør det muligt for en katalysator samtidig at binde et kemikalie tættere og et andet mere løst, afhængigt af kemikaliets naturlige vekselvirkning med katalysatorens atomgitter og den måde, hvorpå belastningsfeltet er konstrueret på katalysatoroverfladen.
"Nu kan du begynde at tænke på virkelig at finjustere katalysatorer til at yde bedre gennem forskellige reaktionstrin, " sagde Peterson. "Det kunne dramatisk forbedre en katalysators ydeevne, afhængigt af de involverede kemikalier."
Petersons team er begyndt at sammensætte en database over almindelige reaktionskemikalier og deres interaktioner med forskellige katalysatoroverflader. Denne database kunne tjene som en guide til at finde reaktioner, der kunne drage fordel af belastning og brydning af skaleringsrelationer.
I mellemtiden, Peterson håber, at det arbejde, de har udført indtil nu, vil give det katalysesamfund en ny måde at tænke belastning på.
"Vi forsøger at give en ramme, der giver en mere intuitiv forståelse af, hvordan belastning virker i katalyse, " sagde Peterson. "Så som folk designer nye katalysatorer, de kan tænke på måder, hvorpå de bedre kan udnytte disse belastningseffekter."
 Varme artikler
Varme artikler
-
 At studere virale udbrud i enkeltceller kan afsløre nye måder at besejre dem påKredit:CC0 Public Domain Mange vira, herunder hiv og influenza A, muterer så hurtigt, at identifikation af effektive vacciner eller behandlinger er som at forsøge at ramme et bevægeligt mål. En be
At studere virale udbrud i enkeltceller kan afsløre nye måder at besejre dem påKredit:CC0 Public Domain Mange vira, herunder hiv og influenza A, muterer så hurtigt, at identifikation af effektive vacciner eller behandlinger er som at forsøge at ramme et bevægeligt mål. En be -
 Overgangsmetalfri carbon-carbon-bindingsdannende reaktion:vinylering af azaallylOvergangs-metal-fri vinylering af azaallyl-anioner. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2760 (Phys.org) - Visse funktionelle grupper viser sig ofte i naturlige produkter og biologisk
Overgangsmetalfri carbon-carbon-bindingsdannende reaktion:vinylering af azaallylOvergangs-metal-fri vinylering af azaallyl-anioner. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2760 (Phys.org) - Visse funktionelle grupper viser sig ofte i naturlige produkter og biologisk -
 Jernbaserede katalysatorer opdaget ved lysdreven kuldioxidhydrogeneringFig. 1. FeOx/Fe til reduktion af CO2 til værditilvækst kulbrinter. Kredit:ZHANG et al. Kinesiske forskere forberedte for nylig en række Fe-holdige katalysatorer fra MgFeAl Layered Double Hydroxide
Jernbaserede katalysatorer opdaget ved lysdreven kuldioxidhydrogeneringFig. 1. FeOx/Fe til reduktion af CO2 til værditilvækst kulbrinter. Kredit:ZHANG et al. Kinesiske forskere forberedte for nylig en række Fe-holdige katalysatorer fra MgFeAl Layered Double Hydroxide -
 Team udvikler ny halvlederbehandlingsteknologiEn konstruktion designet på en sådan måde, at kun grønt lys må passere. Kredit:TU Wien Ekstremt fine porøse strukturer med bittesmå huller, ligner en slags svamp på nanoniveau, kan genereres i hal
Team udvikler ny halvlederbehandlingsteknologiEn konstruktion designet på en sådan måde, at kun grønt lys må passere. Kredit:TU Wien Ekstremt fine porøse strukturer med bittesmå huller, ligner en slags svamp på nanoniveau, kan genereres i hal
- Nøglebyggesten til organiske molekyler opdaget i meteoritter
- Sådan beregnes målefejl
- Forskere:Vinde, der er pisket af klimaet, udgør en fare for Great Lakes
- Grafenfotoniks gennembrud lover høj hastighed, lavpris kommunikation
- Hvordan NASA hjælper verden med at trække vejret lettere
- Sådan beregnes opløseligheder


