Forklar effekten af nitration i opløsning på farveemission?
Her er hvorfor:
* Elektronisk struktur: Nitrationer har en elektronisk konfiguration af lukket skal, hvilket betyder, at alle deres elektroner er parret. Dette forhindrer dem i at absorbere synligt lys, hvilket er nødvendigt for farveemission.
* Mangel på d-orbitaler: I modsætning til overgangsmetalioner, der ofte udviser farve på grund af d-orbitale overgange, mangler nitrationer D-orbitaler. Dette begrænser yderligere deres evne til at interagere med lys på en måde, der producerer farve.
Nitrationer kan imidlertid indirekte påvirke farveemission:
* Indflydelse på metalkomplekser: Hvis en opløsning indeholder en metalion, der danner farvede komplekser, kan tilstedeværelsen af nitrationer påvirke farven på opløsningen. Dette forekommer, fordi nitrationer kan fungere som ligander, binding til metalionen og påvirke dets elektroniske miljø. Dette kan ændre energiniveauet for metalionens D-orbitaler, hvilket fører til, at forskellige bølgelængder af lys bliver absorberet og udsendt, hvilket ændrer den opfattede farve.
* redoxreaktioner: I nogle tilfælde kan nitrationer deltage i redoxreaktioner. Disse reaktioner kan producere farvede arter som produkter. F.eks. Reduktion af nitrationer til nitritioner (ingen 2 - ) kan generere en gul farve i opløsning.
Sammenfattende er nitrationer i sig selv farveløse i opløsning og udsender ikke direkte farve. De kan dog indirekte påvirke farveemission ved at påvirke dannelsen af farvede metalkomplekser eller deltage i redoxreaktioner, der producerer farvede produkter.
Sidste artikelHvad ville virkningen være af nitration i en løsning på farveemission?
Næste artikelHvad er anvendelserne af vismut?
 Varme artikler
Varme artikler
-
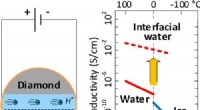 Forskere måler elektrisk ledningsevne af rent grænsefladevandGrafisk abstrakt. Kredit: Journal of Physical Chemistry Letters Skoltech-forskere i samarbejde med forskere fra universitetet i Stuttgart, Karlsruhe Institute of Technology og Russian Quantum Cen
Forskere måler elektrisk ledningsevne af rent grænsefladevandGrafisk abstrakt. Kredit: Journal of Physical Chemistry Letters Skoltech-forskere i samarbejde med forskere fra universitetet i Stuttgart, Karlsruhe Institute of Technology og Russian Quantum Cen -
 Pulverisering af elektronisk affald er grønt, ren - og koldPrintplader fra elektronik, som computermus, kan knuses til nanodstøv af en kryomølle, ifølge forskere ved Rice University og Indian Institute of Science. Støvet kan derefter let adskilles i dets komp
Pulverisering af elektronisk affald er grønt, ren - og koldPrintplader fra elektronik, som computermus, kan knuses til nanodstøv af en kryomølle, ifølge forskere ved Rice University og Indian Institute of Science. Støvet kan derefter let adskilles i dets komp -
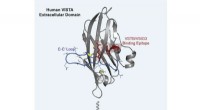 Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af
Ny indsigt i et kræftbeskyttende protein kan guide en ny generation af kræftbehandlingerVed hjælp af en kombination af beregning og eksperiment, forskere var i stand til at kortlægge formen på VISTA, et checkpoint protein, der forsvarer kræftceller mod immunsystemangreb, samt den del af -
 Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e
Nye 2-D spektroskopi metoderI EEI2D spektroskopi (venstre), to oprindeligt adskilte excitationer (gule pile) mødes. Med 2D massespektrometri (højre), ionfotoprodukter (sorte pile) detekteres. Kredit:Tobias Brixner, JMU Sæt e
- Er maltose et proteinlipid eller kulhydrat?
- Hvornår kan en enkelt celle kaldes organisme?
- Udviklingen af livet i havet ændrede sig for 170 millioner år siden
- Hvad produceres, når brint og ilt reagerer sammen?
- Årsag markedsføring:Altruisme eller grådighed?
- Hvordan så får du videnskabelig notation på ord?


