En forbindelse, der består af positive og negative ioner?
Her er hvorfor:
* positive ioner (kationer): Disse dannes, når et atom mister en eller flere elektroner. De har en netto positiv opladning.
* negative ioner (anioner): Disse dannes, når et atom får en eller flere elektroner. De har en netto negativ opladning.
hvordan ioniske forbindelser dannes:
Ioniske forbindelser dannes på grund af den elektrostatiske tiltrækning mellem modsat ladede ioner. De positive og negative afgifter balanserer, hvilket resulterer i en neutral forbindelse.
Eksempler på ioniske forbindelser:
* natriumchlorid (NaCl): Natrium (Na+) og chlorid (Cl-) ioner
* magnesiumoxid (MGO): Magnesium (Mg2+) og oxid (O2-) ioner
* kaliumiodid (KI): Kalium (K+) og iodid (I-) ioner
Nøgleegenskaber for ioniske forbindelser:
* høje smelte- og kogepunkter: Stærke elektrostatiske kræfter kræver en masse energi for at bryde.
* Krystallinsk struktur: Ioner er arrangeret i et almindeligt, gentagende mønster.
* ledende i den smeltede tilstand eller opløst i vand: Ionerne kan bevæge sig frit og bære elektrisk strøm.
* normalt opløseligt i vand: Vandmolekyler kan adskille ionerne.
 Varme artikler
Varme artikler
-
 Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff
Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff -
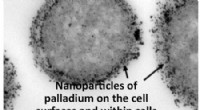 Forskere identificerer billigere, grønnere katalysator til behandling af biobrændstofferEt mikrofotografi af palladium- og bakteriekatalysatoren. Kredit:Lynne Macaskie Brændstoffer, der er produceret fra ikke-råoliebaserede biologiske kilder, kan blive grønnere og mere overkommelige,
Forskere identificerer billigere, grønnere katalysator til behandling af biobrændstofferEt mikrofotografi af palladium- og bakteriekatalysatoren. Kredit:Lynne Macaskie Brændstoffer, der er produceret fra ikke-råoliebaserede biologiske kilder, kan blive grønnere og mere overkommelige, -
 Design af naturbaserede syntetiske materialerKredit:CC0 Public Domain Siden menneskehedens begyndelse udvikler og forbedrer vi materialer med bedre og mere optimerede materialeegenskaber. Ved at forstå, hvordan naturlige materialer fremstill
Design af naturbaserede syntetiske materialerKredit:CC0 Public Domain Siden menneskehedens begyndelse udvikler og forbedrer vi materialer med bedre og mere optimerede materialeegenskaber. Ved at forstå, hvordan naturlige materialer fremstill -
 Mikroskop på en chip kunne bringe medicinsk ekspertise til fjerne patienterForskere reducerer størrelsen og omkostningerne ved mikroskoper, hvilket kunne gøre dette udstyr mere tilgængeligt og lette hurtigere diagnose af sygdomme som kræft. Kredit:Ed Uthman/Flickr, licensere
Mikroskop på en chip kunne bringe medicinsk ekspertise til fjerne patienterForskere reducerer størrelsen og omkostningerne ved mikroskoper, hvilket kunne gøre dette udstyr mere tilgængeligt og lette hurtigere diagnose af sygdomme som kræft. Kredit:Ed Uthman/Flickr, licensere
- Hvad er universet lavet af?
- En ubrydelig kombination af usynlig blæk og kunstig intelligens
- Hvad giver stjernevarme og lys?
- Hvorfor er der så mange vulkaner i Etiopien?
- Varmestress eskalerer i byer under global opvarmning
- Eksperimenter afgør en langvarig debat om mystiske array-formationer i nanofilm


